
Читайте также:
|
Чтобы вычислить потери осадка при его промывании, по произведению растворимости определяют концентрацию ионов в промывной жидкости, которая после соприкосновения с осадком превращается в насыщенный раствор. Далее находят массу осадка в 1л насыщенного раствора, а затем в объёме промывной жидкости, израсходованной на всё промывание.
ПРИМЕР 5.1 Вычислить потерю от растворимости при промывании 0,1г осадка СаС2О4 в 200 мл воды. ПРСаС2О4=2,3∙10-9.
Решение: Вычислим растворимость СаС2О4 (моль/л).
Согласно уравнению диссоциации, из х моль/л оксалата кальция получим: [Са2+]= х, [С2О42-] = х: СаС2О4 = Са2+ + С2О42-.
ПР = [Са2+]∙[С2О42-] = х 2 =2,3∙10-9;
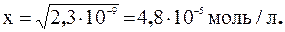
Определим массу СаС2О4 (Мr = 128), который будет содержаться в 200 мл раствора: m = C(СаС2О4).V (р-ра).Мr (СаС2О4),
m (СаС2О4) = 4,8∙10-5∙128∙0,2 = 0,0012г.
Находим потерю при промывании осадка:
0,1г осадка СаС2О4 - 100%
0,0012г растворившегося СаС2О4 - у %
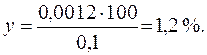
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Что называется раствором?
2. Что называется энергией растворения? Какие факторы влияют на эту величину?
3. Что называется теплотой гидратации?
4. Какие растворы называют ненасыщенными, насыщенными и пересыщенными?
5. Понятие индукционного периода растворения.
6. Что такое растворимость? В каких единицах она может быть выражена, и от каких факторов зависит?
7. Понятие коэффициента растворимости.
8. Классификация веществ по растворимости.
9. От каких факторов зависит растворимость газов в газах?
10. Закон Генри.
11. Почему растворимость газов в воде уменьшается с повышением температуры? Как она зависит от давления (Закон Генри-Дальтона)?
12. Понятие коэффициента поглощения.
13. Уравнения Менделеева-Клаузиуса, Сеченова.
14. От каких факторов зависит растворимость жидкостей в жидкости?
15. Механизм образования твердой фазы.
16. Чем объясняется возможность, как повышения, так и уменьшения растворимости твердых веществ с ростом температуры?
17. Что называют произведением растворимости? Какое свойство вещества характеризуется этой величиной?
18. Как связаны между собой произведение растворимости (ПР) и растворимость вещества S для бинарных, трехионных, четырех- и пятиионных труднорастворимых электролитов?
19. Что такое активность? Коэффициент активности? В каких случаях он равен единице?
20. Что такое ионная сила раствора? Правило ионной силы.
21. В каком случае раствор соли ненасыщен:
1) [А+] [В-]>ПР(АВ); 2) [А+] [B-]=ПР(AB); 3) [А+] [В-] <ПР(АВ)? В каком случае будет выпадать осадок соли?
22. Влияние на растворимость температуры, рН раствора, комплесообразования, введение в его насыщенный раствор одноименного иона?
23. Чем определяются неизбежные потери вещества при его очистке методом перекристаллизации?
24. Солевой эффект осаждения.
25. Понятие дробного осаждения.
26. Использование закона эквивалентов при расчетах весового анализа.
Дата добавления: 2015-07-25; просмотров: 220 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| РАСЧЁТ КОЛИЧЕСТВА ОСАДИТЕЛЯ | | | Опыт 4. Условия растворения осадков |