
|
Читайте также: |
Растворимость – способность веществ равномерно распределятся в виде атомов, молекул или ионов по всему объему растворителя. Количественно растворимость выражают коэффициентом растворимости. Коэффициент растворимости показывает, какая максимальная масса веществ может раствориться в 1 л растворителя при данной температуре. Растворимость выражают в г/л. По растворимости в воде вещества делят на 3 группы:
1. Хорошо растворимые (≥10 г вещества в 1 л воды, пример – глюкоза в 1 л воды растворяется 2000 г).
2. Малорастворимые (от 0,01 до 10 г вещества в 1 л воды, пример СаSO4 в 1 литре воды растворяется 2 г).
3. Практически нерастворимые (≤0,01 г вещества в 1 л воды, пример AgCl в 1 литре воды растворится 1,5×10-3 г).
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления – увеличивается. Зависимость растворимости твердых веществ от температуры показывают кривые растворимости. Растворимость многих веществ увеличивается при повышении температуры.
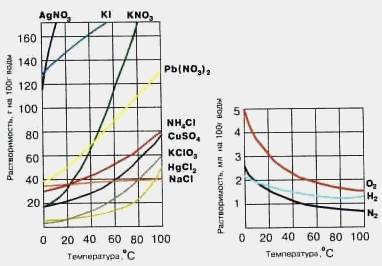
• Молярная растворимость вещества (S, моль/л)–количество растворенного вещества в 1 л его насыщенного раствора:
S = n/V или S = m / M∙V
где: n–количество растворенного вещества, моль
m–масса растворенного вещества, г
M–молярная масса растворенного вещества, г/моль
V–объем насыщенного раствора, л
• Массовая растворимость вещества (Т, г/л)–это масса растворенного вещества в 1 л его насыщенного раствора:
Т= m / V или Т = S ∙ M
Дата добавления: 2015-07-25; просмотров: 43 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Растворы. | | | Ненасыщенные, насыщенные и перенасыщенные растворы. |