
Читайте также:
|
Исходные данные:
1. Имеется большое, но конечное число молекул;
2. Скорости молекул различны 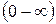 ;
;
3. Движения молекул независимы друг от друга и молекулы обладают случайными энергиями.
Движение молекул газа подчиняется законам статистической физики. В среднем скорости и энергии всех молекул одинаковы. Однако в каждый момент времени энергии и скорости отдельных молекул могут значительно отличаться от среднего значения.
Теория вероятностей позволяет определить долю молекул 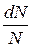 , скорости которых заключены в интервале
, скорости которых заключены в интервале 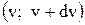
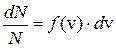 – функция распределения (1)
– функция распределения (1)
где 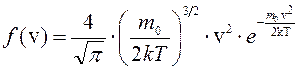 , (2)
, (2)
обозначения:
N – общее число молекул газа,
dN – число молекул, скорости которых заключены в определенном интервале,
v – нижняя граница интервала скоростей,
dv – величина интервала скоростей,
k = 1,38*10–23 Дж/К – постоянная Больцмана,
е=2,718…
m0 – масса молекулы.
Закон распределения Максвелла запишется в следующем виде:
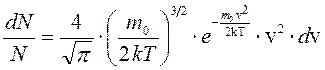 (3)
(3)
График функции распределения f(v)
f(v)
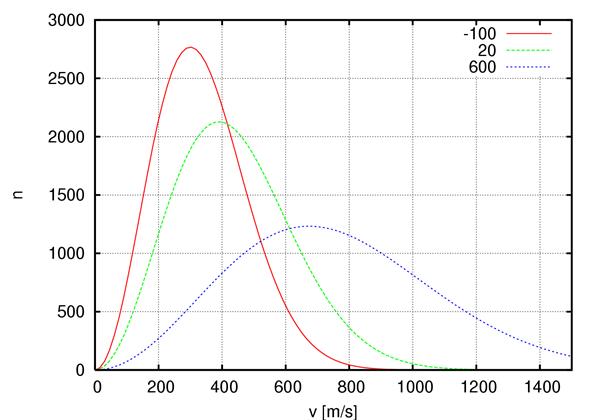
Площадь функции f(v) в интервале скоростей численно равна доле молекул, скорости которых заключены в интервале скоростей 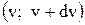 . Площадь функции f(v) по всему интервалу скоростей всегда равна 1.
. Площадь функции f(v) по всему интервалу скоростей всегда равна 1.
Из графика видно, что с ростом температуры газа пик функции смещается вправо и становится меньше.
Распределение Максвелла справедливо для частиц:
– не находящихся в силовом поле
– движения частиц- независимые
– подчиняются законам статистической механики.
Дата добавления: 2015-07-25; просмотров: 141 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Анализ зависимости наиболее вероятной скорости молекул от температуры для данного газа. | | | Средняя (арифметическая) скорость движения молекул |