
Читайте также:
|
В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком электролита и ионами электролита в растворе.
Например: BaSO4 ↔ Ва2+ + SO42–.
в осадке в растворе
В растворах электролитов состояние ионов определяется их активностями, поэтому константа равновесия процесса выразится следующим уравнением:
К= α (Ва2+) · α (SO42-) / α (ВаSO4).
Активность твердого сульфата бария есть величина постоянная, отсюда следует, что произведение активностей ионов Ва2+ и SO42– есть постоянная величина, называемая произведением растворимости, и обозначается
α Ва2+ · α SO42- = ПР ВаSO4.
Если электролит очень мало растворим, то произведение активностей ионов можно заменить произведением их концентраций
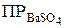 = [Bа2+ ] · [SO42– ].
= [Bа2+ ] · [SO42– ].
Если молекула электролита при диссоциации образует два и несколько одинаковых ионов, то концентрации этих ионов должны быть возведены в соответствующие степени, например:
 = [Cа2+ ] · [F– ]2.
= [Cа2+ ] · [F– ]2.
Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. Растворение же осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения произведения растворимости.
Исходя из значений ПР, можно вычислять растворимость малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
Дата добавления: 2015-07-25; просмотров: 51 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Задача 789 | | | Задача 824 |