
Читайте также:
|
Процентная концентрация (С%) - число граммов растворенного вещества в 100 граммах раствора. Например, 5% раствор поваренной соли содержит 5г соли в 100г раствора. Рассчитать С% можно по формуле
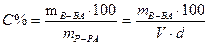 , где mв-ва, mр-ра – масса растворенного вещества и
, где mв-ва, mр-ра – масса растворенного вещества и
масса раствора (г); V× - объем раствора,.мл;
d - плотность раствора г/мл.
Молярная концентрация (См, моль/л) - число молей растворенного вещества в 1 литре раствора. Например, 0,1м раствор поваренной соли содержит 5,85г соли в 1 л раствора. Рассчитать См можно по формуле
 , где М – молекулярная массы растворенного г/моль;
, где М – молекулярная массы растворенного г/моль;
V - объем раствора, мл.
Нормальная концентрация (N, г-экв/л) – число грамм-эквивалентов растворенного вещества в 1 литре раствора. Например, 0,1н раствор серной кислоты содержит 4,9г кислоты в 1 литре раствора. Нормальная концентрация широко используется при расчетах в титрометрических методах анализа растворов.
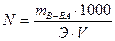 , где Э – эквивалентная масса вещества, г/ моль;
, где Э – эквивалентная масса вещества, г/ моль;
V - объем раствора, мл
Дата добавления: 2015-07-25; просмотров: 58 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химическое равновесие | | | Протолитическое равновесие. |