
Читайте также:
|
Насыщаемость ковалентной связи – это есть число ковалентных связей, которые способен образовать данный атом с другими атомами. Она определяется природой атома и его валентной структурой. Благодаря насыщаемости связи молекулы имеют определенный состав (Н2О, НСl, H3N, H2S и др.).
Разберем это свойство для некоторых атомов.
1) Возьмем атом водорода Н, у которого на 1S-орбитали находится один неспаренный валентный электрон (↑), за счет которого атом Н может образовать одну ковалентную связь, т.е. ковалентность будет равна 1
(Н –Н, Н – Сl).
2) Возьмем атом углерода. Его электронная формула 1s22s22p2, а электронно-структурная схема валентного уровня будет:
│ ↑ │ ↑ │ │
│↑↓│ 2р
2s
т.е. имеет 2 неспаренных электрона, за счет которых может образовать 2 ковалентные связи. Но для углерода (С) характерно образование четырех ковалентных связей. Поэтому атом «С» переходит в возбужденное состояние, т.е. один из двух 2s-электронов переходит на свободную орбиталь 2р-подуровня и тогда станет 4 неспаренных электрона, за счет которых атом С может образовать 4 ковалентные связи, т.е. ковалентность будет равна 4 (СН4, СО2 и др.).
│ ↑ │ ↑ │ │ возбуждение │ ↑ │ ↑ │ ↑ │
 |
2s 2s
Таким образом, максимальная ковалентность атома углерода равна числу валентных орбителей и равна 4.
3) Возьмем атом азота, у которого на 4 валентных орбиталях находятся 5 валентных электрона, три из которых неспаренные:
│ ↑ │ ↑ │ ↑ │
│↑↓│ 2р
2s
За счет трех неспаренных электронов атом N образует 3 ковалентные связи с тремя атомами водорода, у которых по одному неспаренному электрону, при этом образуется молекула NH3:
 N │ ↑ │ ↑ │ ↑ │
N │ ↑ │ ↑ │ ↑ │
│↑↓│ ò ò ò NH3
│ ↓ │ ↓ │ ↓ │
Н Н Н
Кроме того, у атома N осталась еще неподеленная электронная пара, поэтому за счет этой пары электронов азот может образовать с ионом Н+ еще одну (четвертую) ковалентную связь. При этом на образование этой связи атом азота отдаст два электрона (электронную пару), а ион водорода (□Н+) примет эту пару электронов на свою свободную валентную орбиталь. Такая ковалентная связь называется донорно-акцепторной связью, причем азот будет называться донором электронной пары, а ион Н+ называется акцептором электронной пары.
Таким образом, атом N в итоге образовал 4 ковалентные связи: три из них за счет 3 неспаренных электронов и одну связь - по донорно-акцепторному механизму.
 │ ↑ │ ↑ │ ↑ │ В итоге получили ион аммония
│ ↑ │ ↑ │ ↑ │ В итоге получили ион аммония
│↑↓│ NH+4, в котором ковалентность
NH+4 ↓ азота равна 4.
│ ││ ↓ │ ↓ │ ↓ │
Н+ Н Н Н
Таким образом, максимальная ковалентность атома азота равна числу его валентных орбиталей и равна 4.
Ковалентная связь обладает свойством направленности. Орбитали р- и d-типа направлены по координатным осям. В соответствии с направленностью атомных орбиталей происходит и их перекрывание при образовании ковалентной связи, поэтому и ковалентная связь обладает свойством направленности.
Пример 1. Н – Сl При образовании молекулы НСl образуется ковалентнаясвязь при перекрывании s-электронного облака атома Н и р - электронного облака атома хлора, образуется линейная молекула:
Пример 2. Рассмотрим молекулу Н2S. У атома серы два неспаренных р-электрона. В молекуле Н2S образуется две σ- связи за счет перекрывания р-орбиталей атома серы, на которых расположены неспаренные электроны, с s – электронными облаками двух атомов Н. Так как р-орбитали атома серы расположены под углом 90о относительно друг друга, то и валентный угол (это угол между двумя ковалентными связями) тоже должен быть равен 90о. Однако он равен 92о. Это можно объяснить отталкиванием одноименных зарядов δ+ двух атомов Н (т.к. связь S-Н полярна), поэтому валентный угол увеличивается с 90о до 92о. Направленность ковалентной связи зависит также от типа гибридизации валентных орбиталей атома (см. ниже).
3. Гибридизация атомных орбиталей.
Гибридизация – это процесс смешивания (сложения) различных по форме и энергии атомных орбиталей с образованием такого же количества новых, но уже одинаковых по форме и энергии гибридных орбиталей. Гибридная орбиталь имеет большую вытянутость по одну сторону от ядра, чем по другую, поэтому степень ее перекрывания с орбиталью другого атома больше, а значит гибридная орбиталь образует более прочную связь по сравнению с негибридными орбиталями.
Существуют следующие типы гибридизации:
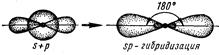
1) sp – гибридизация орбиталей – это гибридизация (смешивание) одной s- и одной р-орбитали, при этом образуются две sp – гибридные орбитали, расположенные симметрично под углом 180о. Поэтому и связи, образуемые с участием этих орбиталей, тоже располагаются под углом 180о. Например, sр-гибридизация орбиталей наблюдается у атома бериллия в молекуле ВеCl2, поэтому эта молекула имеет линейную форму:

2) sр2- гибридизация – это смешивание одной s-орбитали и двух р-орбиталей с образованием трех одинаковых sp2-гибридных орбиталей, расположенных под углом120о относительно друг друга:
Например, sp2-гибридизация валентных орбиталей атома бора в молекуле ВСl3, поэтому эта молекула имеет форму треугольника:

3) sр3-гибридизация – это смешивание одной s– и трех р–орбиталей с образованием четырех гибридных sp3-орбиталей, причем эти гибридные орбитали направлены к четырем вершинам тетраэдра под углом 109о28΄ (сто девять градусов двадцать восемь минут). Такая гибридизация наблюдается в молекулах ССl4, СН4 и др.

Если химическая связь образуется между атомами равных размеров и одинаковой электроотрицательностью, то образуется неполярная ковалентная связь (Н: Н,  ). Если электроотрицательности атомов различны, но не сильно отличаются друг от друга, то происходит смещение электронной плотности (общей электронной пары) к более электроотрицательному атому и образуется полярная ковалентная связь, например в НСl. Нδ+ – Сlδ-.
). Если электроотрицательности атомов различны, но не сильно отличаются друг от друга, то происходит смещение электронной плотности (общей электронной пары) к более электроотрицательному атому и образуется полярная ковалентная связь, например в НСl. Нδ+ – Сlδ-.
Полярность связи количественно выражается дипольным моментом μ = l ∙ q, где μ – дипольный момент связи, l – длина связи, q –абсолютная величина эффективного заряда атома. Дипольный момент выражается в единицах Дебая (Д) или в системе СИ в Кл ∙ м (кулон ∙ метр). μ(НСl) = 1,08 Д или 0,347 ∙ 10-29Кл м. Чем больше значение μ, тем связь более полярная. Дипольный момент связи зависит от разности электроотрицательностей двух атомов, образующих между собой связь.
Поляризуемость связи – это есть способность ковалентной связи поляризоваться (деформироваться) в результате действия на молекулу внешнего электрического поля (или при действии иона и полярной молекулы). При этом неполярная связь становится полярной, а полярная связь становится более полярной. Поляризуемость связи зависит от заряда атомов, образующих связь, от размера атомов и формы орбиталей.
Эффективный заряд атома – это заряд, который возникает на атомах при образовании химической связи между ними вследствие смещения электронной плотности (общей электронной пары) к атому более электроотрицательного элемента Нδ+ - Сlδ-. Согласно опытным данным эффективный (реальный) заряд на атоме водорода составляет δ+ = + 0,18, а на атоме хлора составляет δ- = -0,18 заряда электрона, т.е. связь в молекуле НСl имеет на 18% ионный характер, а на 82% - ковалентный характер (т.е. в НСl ковалентная полярная связь). Чем больше разность электроотрицательностей двух связанных атомов, тем больше на них возникает эффективный заряд.
Дата добавления: 2015-07-25; просмотров: 205 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| И π- связи. | | | Лекция 8. Химическая связь. Метод |