
Читайте также:
|
Химическая связь образуется при перекрывании электронных облаков атомов, причем это перекрывание может происходить разными способами.

|

|
 |
Рисунок 11. Образование σ - связи.
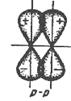
|
Если перекрывание атомных орбиталей (электронных облаков) происходит по обе стороны от линии, соединяющей центры атомов (т.е. вверху и внизу от этой линии), то образуется p- связь (рис. 12).
Рисунок 12. Образование p- связи.
Для образования химической связи (σ- или p - связи) необходимо, чтобы волновые функции ψ в месте перекрывания имели одинаковый знак (или обе с плюсом, или обе с минусом).
Отметим, что s-электронные облака образуют только σ- связи, а р- и d- электронные облака могут при перекрывании образовывать как σ-, так и p-связи.
Кратность или порядок связи - это есть число связей между двумя атомами в молекуле. Кратность связи может выражаться целыми и дробными числами: 1, 2, 1 и т.д. Молекул, в которых кратность связи больше единицы, много. Например, в молекуле N2 содержится тройная связь, т.е. кратность связи равна трем, причем одна связь σ -типа и две другие связи π - типа: N ≡ N. С увеличением кратности связи, как правило, энергия связи увеличивается, а длина связи уменьшается.
2. Основные положения метода валентных связей.
Для объяснения образования химической связи применяются 2 метода:
1) метод валентных связей (ВС);
2) метод молекулярных орбиталей (МО).
Метод ВС исходит из положения, что каждая пара атомов (два атома) в молекуле образуют между собой связь при помощи общих электронных пар.
1) Ковалентная связь образуется при помощи общих электронных пар, образованных из атомов, имеющих неспаренные электроны с противоположно направленными спинами.
2)Ковалентная связь тем прочнее, чем больше степень перекрывания электронных облаков.
3) Ковалентная связь образуется в направлении максимального перекрывания электронных облаков (тогда образуется самая прочная связь).
Таким образом, химическая связь образуется по методу ВС за счет общей пары электронов и эта связь локализована (расположена) между двумя атомами, т.е. она двухэлектронная и двухцентровая. Поэтому метод ВС еще называется методом локализованных электронных пар (ЛЭП).
Дата добавления: 2015-07-25; просмотров: 98 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Лекция 7. Природа химической связи и строение химических соединений | | | Ковалентная связь обладает свойствами насыщаемости, направленности и поляризуемости. Разберем эти свойства. |