
Читайте также:
|
это карбоновые кислоты, содержащие две карбоксильные группы - COOH. Общей формулой HOOC-R-COOH, где R любой двухвалентный органический радикал. Дикарбоновые кислоты это твердые кристаллические вещества, которые получают общими методами синтеза карбоновых кислот.
В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая.
Карбоновые кислоты часто имеют тривиальные названия: муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, валериановая кислота, капроновая кислота, пальмитиновая кислота, стеариновая кислота, акриловая кислота, олеиновая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, адипиновая кислота, лимонная кислота, яблочная кислота, D-винная кислота и др.
Карбоксильные группы характерным образом влияют друг на друга в зависимости от их взаимного расположения. Эта зависимость проявляется, прежде всего, в разном отношении дикарбоновых кислот к нагреванию. Щавелевая и малоновая кислоты разлагаются соответственно при 200 и 150° С, отщепляя диоксид углерода. Янтарная, глутаровая, адипиновая, малеиновая и фталевая кислоты при нагревании легко превращаются во внутренние ангидриды.
 Физические и химические свойства дикарбоновых кислот:
Физические и химические свойства дикарбоновых кислот:
Все дикарбоновые кислоты представляют собой твердые кристаллические вещества, растворимые в воде.
Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными кислотами, чем одноосновные. Двухосновные кислоты вступают во все реакции, свойственные одноосновным кислотам, давая два ряда производных. Специфика их строения приводит к присущим им реакциям образования циклических ангидридов. Хотя аминогруппа и обладает слабым отрицательным индуктивным эффектом, однако она не увеличивает кислотности карбоксила в соответствующих соединениях (аминокислотах), а придает им амфотерные свойства из-за своей основности.
Применение: Щавелевая кислота (этандиовая кислота) – двухосновная предельная карбоновая кислота. Принадлежит к сильным органическим кислотам.
В природе содержится в щавеле, ревене и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция.
15.
Амиды - это класс органических соединений, которые могут рассматриваться как производные от кислот или аминов. Например, простой алифатический амид ацетамид ( ) связан с уксусной кислотой в том смысле, что -OH группа уксусной кислоты заменена в нем
) связан с уксусной кислотой в том смысле, что -OH группа уксусной кислоты заменена в нем  группой. И наоборот, ацетамид может быть расценен как производный аммиака, полученный заменой одного атома водорода ацильной группой. Амиды могут быть получены не только из алифатических или ароматических карбоновых кислот, но также и из других типов кислот, например, из содержащих серу и фосфор.
группой. И наоборот, ацетамид может быть расценен как производный аммиака, полученный заменой одного атома водорода ацильной группой. Амиды могут быть получены не только из алифатических или ароматических карбоновых кислот, но также и из других типов кислот, например, из содержащих серу и фосфор.
Амиды достаточно нейтральны по сравнению с кислотой или аминами, из которых они получены, и иногда достаточно стойки к гидролизу. Простые амиды алифатических карбоновых кислот (кроме формамида) при комнатной температуре являются твердыми веществами, в то время как их замещенные могут быть жидкостями с относительно высокими точками кипения. Амиды ароматических карбоновых или содержащих серу кислот обычно представляют собой твердые вещества.
Физические свойства. Первичные и вторичные амины - полярные соединения и могут образовывать водородные связи с водой. Поэтому низкомолекулярные амины хорошо растворяются в воде.
Низшие алкиламины - газы, высшие - жидкости или твёрдые вещества, которые легко окисляются на воздухе и темнеют. Они обладают неприятным запахом, ядовиты. Физические свойства некоторых аминов представлены в табл. 14.
Таблица 14
| Название | Температура плавления, 0С | Температура кипения, 0С |
| Метиламин | -92 | -7,5 |
| Диметиламин | -96 | 7,5 |
| Триэтиламин | -115 | |
| Анилин | -6 |
Химические свойства. Вследствие того, что азот аминогруппы содержит неподеленную пару электронов, амины проявляют основные свойства.
Амины реагируют с кислотами, присоединяя протон по свободной паре электронов атома азота, образуя соли, аналогичные солям аммония:
R-NH2 + HCl → [R-NH3]+Cl-.
Присоединение протона происходит и в водных растворах аминов:
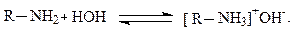
При взаимодействии с кислотами амины превращаются в соответствующие соли аммония. Из этих солей можно опять получить исходный амин, если обработать их сильной щёлочью, например, едким натром. Эти реакции применяют для выделения аминов, обладающих основными свойствами, из нефти и нефтепродуктов, поскольку амины в отличие от других соединений нефти растворяются в разбавленной кислоте и могут быть регенерированы при подщелачивании.
С первичными и вторичными аминами реагирует азотистая кислота. С третичными алкиламинами на холоде она не взаимодействует.

Дата добавления: 2015-07-11; просмотров: 373 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Применение | | | Химические свойства. |