
|
Читайте также: |
ПО ТЕМЕ:
«ОБМЕННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ»
Пример решения задач
Задача 5.1. Записать в ионно-молекулярной форме уравнения реакций между следующими веществами: CH3COONa и H2SO4; Na2CO3 и HNO3; HCN и Ca(OH)2; Pb(NO3)2 и K2CrO4.
Решение: Так как CH3COOH, HCN и H2O - слабые электролиты, а CO2 и PbCrO4 - малорастворимые в воде вещества, искомые уравнения будут иметь вид:
CH3COO– + H+ → CH3COOH
CO32– + 2H+ → CO2↑ + H2O
HCN + OH– → CN– + H2O
Pb2+ + CrO42– → PbCrO4↓
Задачи для самостоятельной работы:
5.2. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: а) Pb(NO3)2 + KI; б) NiCl2 + H2S; в) K2CO3 + HCl; г) CuSO4 + NaOH; д) CaCO3 + HCl; е) Na2SO3 + H2SO4; ж) AlBr3 + AgNO3.
5.3. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений: а) Na2S + H2SO4; б) FeS + HCl; в) HCOOK + HNO3; г) NH4Cl + Ca(OH)2; д) NaOCl + HNO3.
5.4. Написать в ионно-молекулярной форме уравнения реакций нейтрализации: а) HCl + Ba(OH)2; б) HF + KOH; в) Fe(OH)3 + HNO3; г) CH3COOH + NH4OH; д) HNO2 + NH4OH; е) H2S + NH4OH.
Указать, какие из этих реакций протекают обратимо, а какие – необратимо.
5.5. Составить в молекулярной форме уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
NO2– + H+ = HNO2;
Cu2+ + 2OH– = Cu(OH)2↓;
Pb2+ + 2I – = PbI2↓.
5.6. Написать в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ: а) NaHNO3 и HCl; б) FeCl3 и KOH; в) Pb(CH3COO)2 и Na2S; г) KHS и H2SO4; д) Zn(NO3)2 и KOH (избыток); е) Ca(OH)2 и CO2; ж) Ca(OH)2 и CO2 (избыток).
Для каждого случая указать причину смещения равновесия в сторону прямой реакции.
5.7. В каком направлении будет смещено равновесие реакции
AgI (к.) + NaCl (водн.) 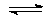 AgCl (к.) + NaI (водн.):
AgCl (к.) + NaI (водн.):
а) в направлении прямой реакции; б) в направлении обратной реакции?
5.8. В каком направлении будет смещено в водном растворе равновесие реакции
CH3COONa+CH2ClCOOH  CH3COOH+CH2ClCOONa:
CH3COOH+CH2ClCOONa:
а) в направлении прямой реакции; б) в направлении обратной реакции?
5.9. Указать какой порядок расположения растворов равной молекулярной концентрации соответствует возрастанию рН:
а) NH4Cl−NaNO3−CH2ClCOONa−NaF−CH3COONa−NaCN;
б) NaCN−CH3COONa−NaF−CH2ClCOONa−NaNO3−NH4Cl.
5.10. Раствор кислоты и раствор основания смешивают в эквивалентных соотношениях. Для каких из перечисленных пар (кислота + основание) раствор будет иметь нейтральную реакцию: а) NH4OH + HCl; б) NH4OH + CH3COOH; в) NaOH + HCl; г) NaOH + CH3COOH?
5.11. Какие из перечисленных ниже солей, подвергаясь частичному гидролизу, образуют основные соли: а) Cr2(SO4)3; б) Na2CO3; в) AgNO3; г) AlCl3?
ВАРИАНТЫ ДОМАШНИХ ЗАДАНИЙ
| Вариант | Номера задач | |||||||
| 1.4 | 1.6 | 2.8 | 3.11 | 3.21 | 4.6(а,в) | 4.23 | 5.7 | |
| 1.5 | 1.7 | 2.2 | 3.6 | 3.22 | 4.7(а,б) | 4.11 | 5.6 | |
| 1.11 | 1.8 | 2.4 | 3.11 | 3.19 | 4.5(а,в) | 4.16 | 5.4 | |
| 1.10 | 1.5 | 2.5 | 3.8 | 3.24 | 4.5(а,б) | 4.15 | 5.8 | |
| 1.12 | 1.6 | 2.7 | 3.9 | 3.25 | 4.9 | 4.27 | 5.5 | |
| 1.6 | 1.11 | 2.4 | 3.6 | 3.24 | 4.14 | 4.22 | 5.6(в,г) | |
| 1.11 | 1.8 | 2.4 | 3.11 | 3.19 | 4.5(а,в) | 4.16 | 5.4 | |
| 1.9 | 1.15 | 2.8 | 3.12 | 3.20 | 4.12 | 4.20(а,в) | 5.6(е,ж) | |
| 1.14 | 1.4 | 2.6 | 3.13 | 3.16 | 4.6(а,б) | 4.26 | 5.11 | |
| 1.15 | 1.6 | 2.7 | 3.14 | 3.26 | 4.17 | 4.20(б,в) | 5.6(д,ж) | |
| 1.6 | 1.11 | 2.4 | 3.6 | 3.24 | 4.14 | 4.22 | 5.6(в,г) | |
| 1.10 | 1.5 | 2.5 | 3.8 | 3.24 | 4.5(а,б) | 4.15 | 5.8 | |
| 1.7 | 1.14 | 2.3 | 3.7 | 3.23 | 4.8(б,в) | 4.24 | 5.2 | |
| 1.4 | 1.16 | 2.2 | 3.17 | 3.22 | 4.18 | 4.25 | 5.6(а,б) | |
| 1.9 | 1.15 | 2.5 | 3.18 | 3.21 | 4.13(б,в) | 4.17 | 5.10 | |
| 1.11 | 1.8 | 2.4 | 3.11 | 3.19 | 4.5(а,в) | 4.16 | 5.4 | |
| 1.4 | 1.6 | 2.8 | 3.11 | 3.21 | 4.6(а,в) | 4.23 | 5.7 | |
| 1.6 | 1.11 | 2.4 | 3.6 | 3.24 | 4.14 | 4.22 | 5.6(в,г) | |
| 1.10 | 1.5 | 2.5 | 3.8 | 3.24 | 4.5(а,б) | 4.15 | 5.8 | |
| 1.14 | 1.4 | 2.6 | 3.13 | 3.16 | 4.6(а,б) | 4.26 | 5.11 | |
| 1.12 | 1.6 | 2.7 | 3.9 | 3.25 | 4.9 | 4.27 | 5.5 | |
| 1.6 | 1.11 | 2.4 | 3.6 | 3.24 | 4.14 | 4.22 | 5.6(в,г) | |
| 1.10 | 1.5 | 2.5 | 3.8 | 3.24 | 4.5(а,б) | 4.15 | 5.8 | |
| 1.4 | 1.6 | 2.8 | 3.11 | 3.21 | 4.6(а,в) | 4.23 | 5.7 | |
| 1.6 | 1.11 | 2.4 | 3.6 | 3.24 | 4.14 | 4.22 | 5.6(в,г) | |
| 1.14 | 1.4 | 2.6 | 3.13 | 3.16 | 4.6(а,б) | 4.26 | 5.11 | |
| 1.7 | 1.14 | 2.3 | 3.7 | 3.23 | 4.8(б,в) | 4.24 | 5.2 | |
| 1.5 | 1.7 | 2.2 | 3.6 | 3.22 | 4.7(а,б) | 4.11 | 5.6 | |
| 1.11 | 1.8 | 2.4 | 3.11 | 3.19 | 4.5(а,в) | 4.16 | 5.4 | |
| 1.6 | 1.11 | 2.4 | 3.6 | 3.24 | 4.14 | 4.22 | 5.6(в,г) |
ПРИЛОЖЕНИЕ
Таблица 1
Константы диссоциации некоторых слабых
электролитов в водных растворах при 25оС
| Электролит | Константа диссоциации | ||
| Азотистая кислота | HNO2 | 2,6∙10-5 | |
| Аммония гидроксид | NH4OH | 4∙10-4 | |
| Борная кислота | H3BO3 | 5,8∙10-4 | |
| Бромноватистая кислота | HOBr | 2,1∙10-9 | |
| Водорода пероксид | H2O2 | 2,6∙10-12 | |
| Кремниевая кислота | H2SiO3 | K1 K2 | 2,2∙10-10 1,6∙10-12 |
| Муравьиная кислота | HCOOH | 1,8∙10-4 | |
| Сернистая кислота | H2SO3 | K1 K2 | 1,6∙10-2 6,3∙10-8 |
| Сероводород | H2S | K1 K2 | 6∙10-8 1∙10-14 |
| Угольная кислота | H2CO3 | K1 K2 | 4,5∙10-7 4,7∙1011 |
| Уксусная кислота | CH3COOH | 1,8∙10-5 | |
| Фосфорная кислота | H3PO4 | K1 K2 K3 | 7,5∙10-3 6,3∙10-8 1,3∙10-12 |
| Циановодород | HCN | 7,9∙10-10 | |
| Щавелевая кислота | H2C2O4 | K1 K2 | 5,4∙10-2 5,4∙10-5 |
Таблица 2
Коэффициенты активности (f) ионов
при различных ионных силах раствора
| Ионная сила раствора I | Заряд иона z | Ионная сила раствора I | Заряд иона z | ||||
| ±1 | ±2 | ±3 | ±1 | ±2 | ±3 | ||
| 0,001 | 0,98 | 0,78 | 0,73 | 0,1 | 0,81 | 0,44 | 0,16 |
| 0,002 | 0,97 | 0,74 | 0,66 | 0,2 | 0,80 | 0,41 | 0,14 |
| 0,005 | 0,95 | 0,66 | 0,55 | 0,3 | 0,81 | 0,42 | 0,14 |
| 0,01 | 0,92 | 0,60 | 0,47 | 0,4 | 0,82 | 0,45 | 0,17 |
| 0,02 | 0,90 | 0,53 | 0,37 | 0,5 | 0,84 | 0,50 | 0,21 |
| 0,05 | 0,84 | 0,50 | 0,21 |
Таблица 3
Произведение растворимости некоторых
малорастворимых электролитов при 25 оС
| Электролит | ПР | Электролит | ПР | Электролит | ПР |
| AgBr | 5,3·10-13 | CaSO4 | 2,5·10-5 | MnS | 2,5·10-10 |
| Ag2CO3 | 8,2·10-12 | Ca3(PO4)2 | 1,0·10-29 | Ni(OH)2 | 6,3·10-18 |
| AgCl | 1,8·10-10 | CdS | 1,6·10-28 | PbBr2 | 9,1·10-6 |
| Ag2CrO4 | 1,1·10-12 | CoCO3 | 1,5·10-10 | PbCO3 | 7,5·10-14 |
| AgI | 8,3·10-17 | Co(OH)2 | 2·10-16 | PbCl2 | 1,56·10-5 |
| Ag2S | 5,3·10-50 | CrPO4 | 2,4·10-23 | PbF2 | 2,7·10-8 |
| Ag2SO4 | 1,6·10-5 | CuCO3 | 2,5·10-10 | PbI2 | 1,1·10-9 |
| Ag3PO4 | 1,3·10-20 | Cu(OH)2 | 1,6·10-19 | PbS | 2,5·10-27 |
| Al(OH)3 | 5·10-33 | CuS | 6,3·10-36 | PbSO4 | 1,6·10-8 |
| AlPO4 | 5,7·10-19 | Fe(OH)2 | 8·10-16 | Pb3(PO4)2 | 7,9·10-43 |
| BaCO3 | 5,1·10-9 | Fe(OH)3 | 6,3·10-38 | Sb2S3 | 1,6·10-93 |
| BaCrO4 | 1,2·10-10 | FePO4 | 1,3·10-22 | SrCO3 | 1,1·10-10 |
| BaSO4 | 11·10-10 | FeS | 5·10-18 | SrCrO4 | 3,6·10-5 |
| Ba3(PO4)2 | 6,0·10-39 | HgS | 1,6·10-52 | SrF2 | 2,5·10-9 |
| BeCO3 | 1·10-3 | MgCO3 | 2,1·10-5 | SrSO4 | 3,2·10-7 |
| CaCO3 | 4,8·10-9 | Mg(OH)2 | 6·10-10 | ZnCO3 | 1,4·10-14 |
| CaF2 | 4,0·10-11 | Mg3(PO4)2 | 1·10-13 | Zn(OH)2 | 1·10-17 |
| CaHPO4 | 2,7·10-7 | MnCO3 | 1,8·10-11 | α-ZnS | 1,6·10-24 |
| Ca(H2PO4)2 | 1·10-3 | Mn(OH)2 | 1,9·10-13 | Zn3(PO4)2 | 9,1·10-33 |
Таблица 4
Интервалы перехода и окраска в различных средах
наиболее распространенных кислотно-основных индикаторов
| Название | Цвет индикатора в различных средах | ||
| Фенолфталеин | бесцветный рН < 8 | бледно- малиновый 8.0 < pH < 9.8 | малиновый pH > 9.8 |
| Лакмус | красный рН < 5 | фиолетовый 5 < рН < 8 | синий рН > 8 |
| Метиловый оранжевый | красный рН < 3.1 | оранжевый | желтый |
| 3.1< рН < 4.4 | рН > 4.4 | ||
| Метиловый фиолетовый | жёлтый рН = 0 | фиолетовый рН > 3 | |
| Бромкрезоловый зелёный | жёлтый рН < 3,8 | синий рН > 5,6 | |
| Бромтимоловый | жёлтый | синий pH > 7,7 | |
| рН < 6 | |||
| Тимоловый синий | красный рН < 0,5 | жёлтый 2,5 < pH < 7,9 | синий pH > 7,9 |
Дата добавления: 2015-07-11; просмотров: 88 | Нарушение авторских прав