
|
Читайте также: |
ПО ТЕМЕ: «ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ»
Примеры решения задач
Задача 3.1. Растворимость гидроксида магния Mg(OH)2 при 18 оС равна
1,7∙10 –4 моль/л. Найти ПР Mg(OH)2 при этой температуре.
Решение: При растворении каждого моля Mg(OH)2 в раствор переходит 1 моль ионов Mg+2 и вдвое больше ионов ОН–.
Mg(OH)2 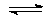 Mg2+ + 2 OH–
Mg2+ + 2 OH–
Следовательно, в насыщенном растворе Mg(OH)2
[Mg2+] = 1,7∙10-4 моль/л; [OH–] = 3,4∙10– 4 моль/л.
Отсюда  .
.
Задача 3.2.  . Вычислить растворимость соли (в моль/л и в г/л) при указанной температуре.
. Вычислить растворимость соли (в моль/л и в г/л) при указанной температуре.
Решение: Обозначим растворимость соли через s (моль/л). Тогда в насыщенном растворе PbI2 cодержится s моль/л ионов Pb2+ и 2s моль/л ионов I–.
PbI2  Pb+2+2I–
Pb+2+2I–
s s 2 s
ПР=[Pb2+][I–]2 = 4 s 3
 ;
;  .
.
Растворимость PbI2, выраженная в г/л, составляет 1,3∙10-3∙461 = 0,6 г/л.
Задача 3.3. Во сколько раз растворимость CaC2O4 в 0,1 М растворе (NH4)2C2O4 меньше, чем в воде?
Решение: Вычислим растворимость CaC2O4 в воде. Пусть концентрация соли в растворе будет s (моль/л), поэтому можем записать
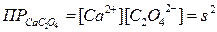

Отсюда,

Найдем растворимость этой соли в 0,1 М растворе (NH4)2C2O4; обозначим её через s ′. Концентрация ионов Ca2+ в насыщенном растворе тоже будет s ′, а концентрация [C2O42–] составит (0,1+ s ′), т.к. s ′<0,1, то можно считать, что [C2O42–] = 0,1моль/л. Тогда  ; s ′=2∙10–8 моль/л. Следовательно, в присутствии (NH4)2C2O4 растворимость СaC2O4 уменьшилась в
; s ′=2∙10–8 моль/л. Следовательно, в присутствии (NH4)2C2O4 растворимость СaC2O4 уменьшилась в  раз, т.е. в 2200 раз.
раз, т.е. в 2200 раз.
Задача 3.4. Смешаны равные объемы 0,02 н. растворов CaCl2 и Na2SO4; образуется ли осадок CaSO4?
Решение: Найдем произведение концентраций ионов Ca+2 и SO42– сравним его с  . Условием выпадения осадка является [Ca2+][SO42–] >
. Условием выпадения осадка является [Ca2+][SO42–] >  .
.
Исходные молярные концентрации растворов CaCl2 и Na2SO4 одинаковы и равны 0,01 моль/л, т.к. при смешении исходных растворов общий объем раствора вдвое больше, то концентрация каждого из ионов вдвое уменьшается по сравнению с исходными. Поэтому [Ca2+] = [SO42–] = 5∙10–3, находим [Ca2+][SO42–] = 2,5∙10–5

2,5∙10-5 < 1,3∙10-4.
Поэтому осадок не образуется.
Задача 3.5. Произведение растворимости CaC2O4 = 2∙10–9. Найти растворимость этой соли в 0,1 М растворе (NH4)2C2O4.
Решение: Выразим ПР  через активность ионов
через активность ионов
 .
.
Обозначив искомую растворимость соли через s, находим, что
[Ca2+] = s моль/л, [C2O42–] = 0,1 моль/л. Таким образом,

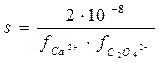
Вычислим ионную силу раствора (I) 0,1 М раствора (NH4)2C2O4
I = 0,5(0,2∙12+0,1∙22) = 0,3
Согласно табл. 2, при этой ионной силе коэффициенты активности двухзарядных ионов равны 0,42. Тогда
 .
.
Задачи для самостоятельной работы:
3.6. Растворимость CaCO3 при 35оС равна 6,9∙10–5 моль/л. Вычислить произведение растворимости этой соли.
3.7. Вычислить произведение растворимости PbBr2 при 25 оС, если растворимость соли при этой температуре равна 1,32∙10–2 моль/л.
3.8. В 500 мл воды при 18 оС растворяется 0,0166 г AgCrO4. Чему равно произведение растворимости этой соли?
3.9. Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
3.10. Исходя из произведения растворимости карбоната кальция, найти массу CaCO3, содержащуюся в 100 мл его насыщенного раствора.
3.11. Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgBr.
3.12. Вычислить объем воды, необходимый для растворения при 25 оС 1 г BaSO4.
3.13. В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
3.14. Во сколько раз растворимость (в моль/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25 оС?
3.15. Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
3.16. К 50 мл 0,001 н. раствора HCl добавили 450 мл 0,0001 н. раствора AgNO3. Выпадет ли осадок хлорида серебра?
3.17. Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3) добавить равный объем 0,4 н. раствора NaCl?
3.18. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Cl- в растворе стала равной 0,03 моль/л?
3.19. Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
3.20. Во сколько раз растворимость AgCl в 0,001 н. растворе NaCl меньше, чем в воде? Расчет произвести с учетом коэффициентов активности, пользуясь данными табл. 2 Приложения.
3.21. В каком из указанных случаев раствор электролита МХ ненасыщен: а) [Mz+][Xz-] < ПР; б) [Mz+][Xz-] = ПР; в) [Mz+][Xz-] > ПР?
3.22. Обозначим растворимость AgCl в воде, в 0,01 М CaCl2, в 0,01 M NaCl и в 0,05 М AgNO3 соответственно через so, s1, s2 и s3. Какое соотношение между этими величинами правильно: а) so > s1 > s2 > s3; б) so > s2 > s1 > s3; в) so > s1 = s2 > s3; г) so > s2 > s3 > s1?.
3.23. К 0,01 н. раствору H2SO4 медленно добавляют раствор, содержащий 0,01 моль/л CaCl2 и 0,01т моль/л SrCl2. Какой осадок начнет выпадать раньше: а) SrSO4; б) CaSO4?
3.24. Произведения растворимости солей NiC2O4 и Na3AlF6 одинаковы (4∙10-10). Какое соотношение между растворимостями (моль/л) этих солей правильно:
а) 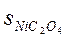 >
>  ; б)
; б)  =
= 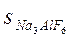 ; в)
; в)  <
< 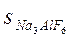
3.25. Произведения растворимости AgBrO3 и Ag2SO4 равны соответственно 5,5∙10-5 и 2∙10-5. укажите правильное соотношение между растворимостями (s, моль/л) этих солей:
а)  <
<  ; б)
; б)  ≈
≈  ; в)
; в)  >
>  .
.
3.26. Как изменится растворимость CaF2 в 0,1 М растворе KNO3 по сравнению с его растворимостью в воде:
а) возрастет; б) уменьшится; в) останется неизменной?
Дата добавления: 2015-07-11; просмотров: 198 | Нарушение авторских прав