
Читайте также:
|
В основе расчета кривой титрования лежит реакция:
НСООН + КОН = НСООК + Н2О
НСООН + ОН- = НСОО- + Н2О
НСООН - слабая кислота; НСОО- - сопряженное основание
2.1 Вычисление pH раствора до начала титрования.
В водном растворе ионизация слабой кислоты определяется константой Ка, т.е. имеет место сосуществование слабой кислоты и сопряженного с ней основания.
HСООН + H2O à НСОО- + H3O+



2.2 Вычисление pH раствора в процессе титрования до точки эквивалентности.
При добавлении титранта КОН равновесие протонного переноса смещается вправо вследствие взаимодействия КОН с H3O+ . Система представляет раствор кислотно-основной пары, НСООН и НСОО- , в которой по мере титрования уменьшается концентрация кислоты и увеличивается концентрация сопряженного основания. Такие растворы обладают свойством буферной системы, и кислотность рассчитывается по формуле:


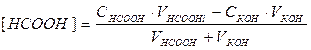

а) Vтитр=4 мл.

б) Vтитр=8 мл.

в) Vтитр=12 мл.
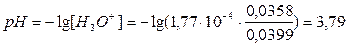
г) Vтитр=16 мл.

д) Vтитр=19 мл.

е) Vтитр=22 мл.
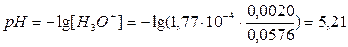
2.3 Вычисление pH в точке эквивалентности.
Когда слабая кислота полностью оттитрована, в растворе присутствует соль НСООК. Катион К+ не проявляет кислотно-основных свойств, а анион НСОО- обладает свойствами сопряженного основания, и кислотность раствора определяется концентрацией основания и его величиной Кв.
НСОО- + H2O à HСООН + OН -

Объем титранта в точке эквивалентности вычисляют по формуле:
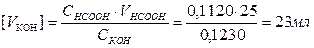

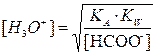

2.4 Вычисление pH раствора после точки эквивалентности.


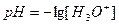
Vтитр=27 мл.

2.5 Расчет двух точек скачка титрования.
a) Оттитровано 99,9 %.
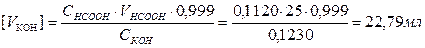
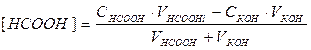 ;
; 

б) Оттитровано 100,1%.



Зависимость pH раствора от количества добавленного титранта
Дата добавления: 2015-07-11; просмотров: 76 | Нарушение авторских прав