
|
Читайте также: |
Газовая коррозия – коррозия металлов в газах при высоких температурах – является наиболее распространенным и практически важным видом химической коррозии металлов.
Газовая коррозия имеет место при работе многих металлических деталей и аппаратов в условиях повышенных температур (арматура печей, двигатели внутреннего сгорания, химические реакторы), при обработке металлов при высоких температурах (прокатка, ковка, термическая обработка и т.д.).
Поведение металлов при высоких температурах может быть
описано с помощью двух важных характеристик – жаростойкости и жаропрочности.
Продуктами газовой коррозии являются оксидные пленки, структура и состав которых в одних случаях не отличается от таковых соответствующего соединения в компактной форме, в других же имеет существенные отличия.
Скорость газовой коррозии и закона роста оксидной пленки
в значительной мере зависят от ее защитных свойств.
У пленок, не обладающих защитными свойствами, скорость роста постоянная и контролируется скоростью химической реакции образования оксида (кинетическая область). В этом случае наблюдается линейный закон роста пленки:
 , (1.1)
, (1.1)
где х – толщина образующейся пленки продуктов коррозии; к1 – постоянная; t – время окисления.
У сплошных пленок, обладающих защитными свойствами, скорость роста часто контролируется диффузией реагентов (диффузионная область). В этом случае наблюдается параболический закон роста пленки:
 , (1.2)
, (1.2)
где к2 – постоянная; t – время окисления.
Если скорость роста пленки контролируется и скоростью химической реакции и скоростью диффузии (смешанная диффузионно-кинетическая область), то в этом случае закон роста пленки описывается уравнением сложно-параболического закона окисления (уравнение Эванса):
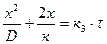 , (1.3)
, (1.3)
где D – коэффициент диффузии; к – константа скорости реакции
образования оксида; к3 – постоянная:
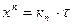 , (1.4)
, (1.4)
где n – показатель, лежащий в пределах от 1 до 2; кn – постоянная.
На основании опытных данных по изменению массы образца во времени можно получить уравнение, которое позволяет судить о механизме и контролирующем факторе процесса.
Дата добавления: 2015-07-11; просмотров: 224 | Нарушение авторских прав