
Читайте также:
|
Для реального газу рівняння стану відрізняється від рівняння стану ідеального газу тим, що в ньому введені певні поправки, які враховують розмір молекул і сили взаємодії між ними. В наших задачах обмежимось лише рівнянням Ван – дер - Ваальса, яке для 1 моля газу має вигляд:
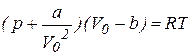 (50)
(50)
де V0 – об’єм одного моля газу, p - тиск газу, T - його температура, a, b – сталі Ван-дер-Ваальса (сталі для даного газу, але різні для різних газів). Для деяких газів значення приведені в таблиці.
| Речовина | a, Дж м3/моль2 | b, 10-5 м3/моль |
| Азот (N2) | 0.136 | 3.8 |
| Аргон (Ar) | 0.132 | 3.2 |
| Вода (H2O) | 0.554 | 3.0 |
| Водень (H2) | 0.024 | 2.7 |
| Вуглекислий газ (CO2) | 0.364 | 4.3 |
| Кисень (O2) | 0.137 | 3.2 |
| Гелій (Не) | 0.003 | 2.2 |
Поправка 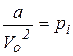 визначає внутрішній (молекулярний) тиск, який існує в об’ємі одного моля газу внаслідок взаємодії молекул. Поправка на об’єм молекул b пов’язана з власним об’ємом молекул. Вона дорівнює:
визначає внутрішній (молекулярний) тиск, який існує в об’ємі одного моля газу внаслідок взаємодії молекул. Поправка на об’єм молекул b пов’язана з власним об’ємом молекул. Вона дорівнює:
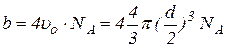 (51)
(51)
де 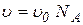 - об’єм усіх молекул моля газу, d - ефективний діаметр молекул (наведені нижче в таблиці).
- об’єм усіх молекул моля газу, d - ефективний діаметр молекул (наведені нижче в таблиці).
Для довільної маси газу m рівняння Ван-дер-Ваальса набуває вигляду:
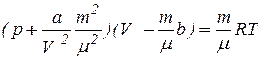 (52)
(52)
де V - об’єм газу,  - кількість молів газу.
- кількість молів газу.
| Речовина | d, 10-10 м | Речовина | d, 10-10 м |
| Азот (N2) | 3.1 | Водяна пара (H2O) | 2.9 |
| Аргон (Ar) | 2.9 | Гелій (Не) | 1.9 |
| Водень (H2) | 2.7 | Кисень (O2) | 2.9 |
| Вуглекислий газ (CO2) | 3.3 | Оксид вуглецю (СО) | 3.2 |
Дата добавления: 2015-07-12; просмотров: 120 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Явища переносу. | | | Критичний стан. |