
Читайте также:
|
Основи молекулярно-кінетичної теорії ідеальних газів.
Рівняння стану ідеальних газів.
Рівняння, що зв’язує  – об’єм,
– об’єм,  – абсолютну температуру та
– абсолютну температуру та 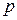 – тиск газу, називають рівнянням стану. Для ідеальних газів рівняння стану Менделєєва – Клапейрона має вигляд
– тиск газу, називають рівнянням стану. Для ідеальних газів рівняння стану Менделєєва – Клапейрона має вигляд
 , (1)
, (1)
де  – маса,
– маса,  – молярна маса газу,
– молярна маса газу,  = 8.31 Дж/моль- газова стала (універсальна фізична стала). Відношення
= 8.31 Дж/моль- газова стала (універсальна фізична стала). Відношення  = ν має назву кількості речовини і характеризує кількість молей газу. Кількість молекул в одному молі всіх газів однакова і дорівнює
= ν має назву кількості речовини і характеризує кількість молей газу. Кількість молекул в одному молі всіх газів однакова і дорівнює  = 6,02∙1023 1/моль (число Авогадро – універсальна фізична стала). Для ν молей газу кількість молекул буде дорівнювати
= 6,02∙1023 1/моль (число Авогадро – універсальна фізична стала). Для ν молей газу кількість молекул буде дорівнювати 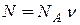 . Якщо газ складається з однакових молекул масою
. Якщо газ складається з однакових молекул масою  , то очевидно, що
, то очевидно, що  =
= 
 .
.
Виходячи з того, що густина газу визначається як 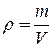 , з рівняння стану можна отримати значення
, з рівняння стану можна отримати значення 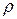 при даних умовах
при даних умовах
 . (2)
. (2)
Концентрація молекул  =
= 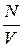 зв’язана з густиною газу співвідношенням
зв’язана з густиною газу співвідношенням 

 . При цьому з рівняння стану (1) можна отримати вираз
. При цьому з рівняння стану (1) можна отримати вираз
 , (3)
, (3)
в якому введена величина  = 1,38∙10-23 Дж/К- стала Больцмана.
= 1,38∙10-23 Дж/К- стала Больцмана.
Для сумішей газів можна використовувати рівняння стану (1), поняття густини газу, концентрації молекул, молярної маси суміші. В основі їх коректного використання лежить закон Дальтона: тиск суміші газів дорівнює сумі їхніх парціальних тисків, тобто
 . (4)
. (4)
Парціальний тиск — це тиск, який чинить будь-яка з компонент суміші у відсутності усіх інших в тій самій посудині при тій самій температурі. Для знаходження молярної маси суміші треба використати визначення кількості речовини та врахувати адитивність маси і кількості речовини газу:

 (5),
(5),
звідки знаходимо шукану молярну масу суміші μсум.
Дата добавления: 2015-07-12; просмотров: 104 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Задача №17 | | | Ізопроцеси. |