
|
Читайте также: |
Перехід газу із стану 1, який характеризують параметри (p1, V1, T1) до стану 2 з параметрами(p2,V2,T2) називають термодинамічним процесом. Якщо перехід 1–2 реалізують квазістатично, тобто через послідовність рівноважних станів, то процес є оборотним, і його можна представити графічно (Рис.1). Якщо при переході 1–2 один з параметрів (p, V, T) залишається сталим, то процеси називають ізотермічним ( = const), ізобарним (
= const), ізобарним (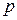 = const), ізохорним (
= const), ізохорним ( = const).
= const).
Рівняння для кожного ізопроцесу можна записати в одному з двох виглядів:

|
Ізотермічний
( =const) =const)
| 
| 
| (6) |
ізобарний
(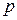 =const) =const)
| 
| 
| (7) |
ізохорний ( =const) =const)
| 
| 
| (8) |
Значення сталих (соnst1 , соnst2 , соnst3) визначаються з рівняння стану (1).
Для ізотермічних процесів збільшення температури веде до зростання сталої соnst1 і графіки, що відповідають приведеним функціям при ( ), показані на рис.1. а.
), показані на рис.1. а.
В рівнянні ізобарного процесу стала соnst2 обернено пропорційно залежить від тиску. Тому при зростанні цього параметру ( ) кут нахилу прямої
) кут нахилу прямої 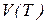 зменшується (рис.1, б).
зменшується (рис.1, б).
В рівнянні ізохорного процесу стала соnst3 обернено пропорційно залежить від об’єму, тому збільшення об’єму веде до зменшення кута нахилу прямої  (рис.1, в).
(рис.1, в).
Відповідні залежності, показані в таблиці, мають назви законів: Бойля-Маріотта (ізотермічний процес), Гей-Люссака (ізобарний процес), Шарля (ізохорний процес).
Дата добавления: 2015-07-12; просмотров: 105 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Рівняння стану ідеальних газів. | | | Внутрішня енергія ідеального газу. |