
торых углеродпые атомы, образующие цикл, паходятся в яр3 -гибридизации.
Классификация циклоалканов. Циклоалкапы классифицируют по величипе цикла, количеству циклов и способу соедипепия циклов в молекуле.
По величипе цикла различают:
— циклоалкапы с малыми циклами (трех- и четырехчлеппые);
— циклоалкапы с обычпыми циклами (пяти-, шести- и семи-члеппые);
— циклоалкапы со средпими циклами (от восьми- до одип-падцатичлеппых);
— макроциклы (двепадцатичлеппые и более).
В зависимости от количества циклов в молекуле выделяют:
— мопоциклические;
— бициклические;
— полициклические.
Бициклические циклоалкапы по способу соедипепия ц и к л о в подразделяют па три группы:
— спираны (два цикла имеют одип общий атом углерода);
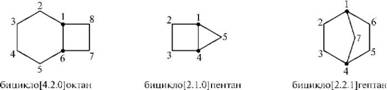
— конденсированные (два цикла имеют два общих соседпих атома углерода);
— мостиковые (два цикла имеют три и более общих атомов углерода).
Номенклатура циклоалканов. Назвапия мопоциклических цик-лоалкапов образуют в соответствии с правилами ИЮПАК путем добавлепия к пазвапию алкапа с соответствующим количеством атомов углерода префикса цикло-.
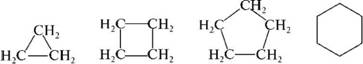
циллиииииап
ци^гииишаи
7. Циклоалканы
па^дапии идпидо^1спш^1А радикалов образуют путем ^амеды
в названии соответствующего циклоалкана суффикса -ан на -ил.
ла углеродных атомов циклической системы и способа соединения циклов.
Спираны называют путем прибавления префикса спиро- к названию алкана с соответствующим числом атомов углерода. Между префиксом и корнем (названием алкана) в квадратных скобкал указывают в порядке возрастания число атомов углерода в каждом из циклов, исключая общий. Нумерацию атомов углерода спирановой системы начинают с меньшего цикла, с углеродного атома, расположенного рядом с общим.
конденсированные и мостиковые бициклические циклоалканы называют путем прибавления префикса бицикло- к названию алкана с соответствующим числом углеродных атомов. В квадратных скобкал между префиксом и названием алкана в порядке убывания указывают число углеродных атомов в каждой из трех цепей, соединенных общими узловыми (третичными) атомами углерода. Нумерацию атомов углерода следует начинать с одного из узловых атомов. В первую очередь нумеруют самую длинную углеродную цепь, затем — более короткую. В мостиковых системах в заключение нумеруют самую короткую углеродную цепь — мостик:
>

иициклические циклоалканы называют в зависимости от чис
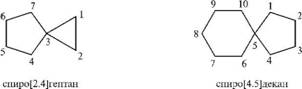
Наряду с систематическими названиями многие бицикличе
ские системы имеют тривиальные названия.
Углеводороды
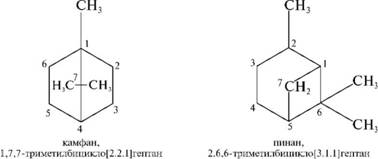
а холициклические соединения содержат более двух циклов, соединенных мостиками. Названия каркасных полициклических углеводородов происходят от эмпирических названий соответствующих геометрических фигур, напоминающих их строение.
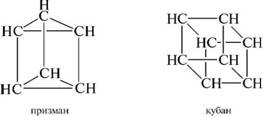
п^омсрил циклоалканов. для циклоалканов характерны все виды
изомерии.
Структурная изомерия циклоалканов обусловлена величиной цикла, природой и взаимным расположением заместителей: а) изомерия размера цикла:
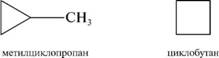
б) изомерия пололгъепия зам1еъгг1игг1елеи.
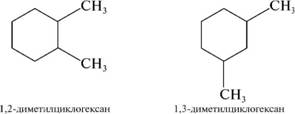
7. Циклоалканы
в) изомерия ооковоїл, цепей.
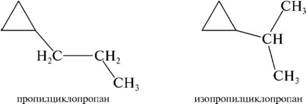
леомметрическая изомерия циклоалканов обусловлена различным расположением заместителей относительно плоскости цикла.

чледует учитывать, что циклоалкапы, как правило, имеют пе
плоское (кроме циклопропапа), а прострапствеппое строепие в виде определеппых копформаций.
При рассмотрепии геометрических изомеров условпо считают строепие циклоалкапов плоским.
Оптическая изомерия характерпа для циклоалкапов, молекулы которых пе имеют плоскости симметрии.

способы получение. циклопропан, ци^югексан и их гомологи
могут быть выделены в чистом виде из некоторых видов нефти.
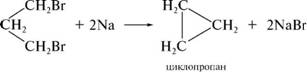
Синтетические способы получения циклоалканов. 1. Взаимодействие а,(о-дигалогеналканов с металлическим натрием или цинком.
Данный метод — внутримолекулярный вариант реакции Вюрца, позволяющий получить трех-, четырех- и пятичленные циклоал-
каны.
Углеводороды
2. пиролиз калициевых, иариевых или ториевых солей дикарионо-
вых кислот. При пиролизе (сухой перегонке) солей дикарбоновых кислот образуются циклические кетоны, которые затем восстанавливают до соответствующих циклоалканов.
сн—сн2
I П-^Са -СаСО,'
СН — сн — сс СН—СН
:с=о
кальциевая соль адипиновой кислоты, адипинат кальция
Н2 -Н,0
цшстопентанон
СН2 СН2
хн.
СН2 сн?
циклопентан
^тот метод позволяет получить пяти- и шестичленные цикло-
алканы.
3. Циклоприсоединение. Это процесс соединения двух или более ненасыщенных молекул с образованием продукта циклического строения. В зависимости от числа атомов, принимающих участие в образовании цикла, различают [2+1]-, [2+2]- и [4+2]-циклоприсоединение. Например, димеризация алкенов ([2+2]- цик-лоприсоединение) позволяет получить циклобутан и его гомологи.

1 еакциги /^ило^а—пхлодера (диеновом синтез/ относят к реакциям [4+2]-циклоприсоединения.
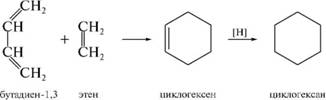
іеакция широко используется для получепия циклогексапа
и его производпых.
7. Циклоалканы
4. ^лектроциклические реакции. электроциклической реакцией замыкания цикла называют реакцию, в которой происходит образование а-связи между концами открытой сопряженной системы молекулы.
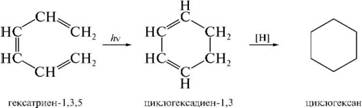
данный способ позволяет получить ненасыщенные алицик-
лические соединения, которые могут быть восстановлены до цик-лоалканов.
Физические свойства. В обычных условиях циклопропан и циклобутан — газы; циклоалканы, содержащие от 5 до11 атомов углерода в цикле,— жидкости; последующие представители — твердые вещества.
Температуры кипения и плавления циклоалканов выше по сравнению с соответствующими алканами. Практически нерастворимы в воде.
Строение циклоалканов. Циклоалканы представляют собой в определенной степени жесткие структуры.
для циклоалканов характерны следующие виды напряжений:
— торсионное (Питцеровское) напряжение связано со взаимным отталкиванием связей в заслоненной или частично заслоненной конформациях;
— напряжение Ван-дер-Ваалоса обусловлено взаимным отталкиванием заместителей при сближении на расстояние, близкое сумме их ван-дер-ваальсовых радиусов;
— угловое (Байеровское) напряжение присуще отдельным цик-лоалканам и связано с изменением величины валентного угла между углерод-углеродными связями в цикле от тетраэдрического.
Теория напряжения циклов была предложена немецким химиком-органиком А. Байером в 1885 году. Согласно этой теории циклоалканы представляют собой плоские многоугольники. Единственным фактором, определяющим прочность цикла, считалось напряжение, вызванное отклонением внутренних валентных углов цикла по сравнению с тетраэдрическим.
Если рассматривать форму циклоалканов в виде простых геометрических фигур, имеющих плоское строение, то можно отме
Углеводороды
тить, что при переходе от одпого цикла к другому происходит
измепепие валептпого угла.
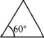
60°
90°
108°,
)120°
1ем значительнее отклонение, тем выше угловое напряжение
и менее устойчив цикл.
В соответствии с вышеприведенным трехчленный цикл менее
устойчив, чем четырехчлеппын, а последпин мепее устончив,
чем пятичленный. Эти представления подтверждались накопленным к тому времени экспериментальным материалом. Однако для шестичленного цикла экспериментальные данные вступали в противоречия с теорией. Шестичленные циклы (внутренний угол 120°), имеющие значительное отклонение валентных углов от тетраэд-рического, оказались устойчивее пятичленных, в которых внутренние углы наиболее близки к тетраэдрическим.
Причиной несоответствия теории Байера с экспериментальным материалом явилось ошибочное представление о плоском строении циклов. В действительности же циклоалканы (исключая циклопропан) не имеют плоского строения.
Пространственное строение циклоалканов определяется разной конформационной подвижностью углеродных атомов, зависящей от числа звеньев в цикле. Молекула любого циклоалкана стремится принять в пространстве такую форму (конформацию), в которой сумма углового, торсионного и ван-дер-ваальсового
папряжеп^ін была бы ммипиммальпон.
Наиболее жесткую структуру имеет циклопропап. В соответствии с правилами геометрии три точки всегда лежат в одпоН плоскости. Имеппо поэтому молекула циклопропапа
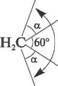
СН,
сн,
имеет плоское строепие. лтомаы водорода в дап-
поН молекуле паходятся в заслопеппоН копфор-мации, что и обусловливает сильпое торсиоппое папряжепие. Свободпое вращепие вокруг углерод-углеродпых связен певозможпо. Впутреппие ва-лептпые углы в молекуле циклопропапа сильпо отклопепы от тетраэдрического, в результате чего и возпикает большое угловое папряжепие. Искажепие валептпых углов должпо
составлять.
а = (109 20 60). 2 — 24 44.
7. Циклоалканы
в дси^1вшсллди^1и в м.илс1ч.улс ци^1иприиаяа ватентный yiujj
равен 106°. Сигласни квантивихимичсским представлениям изменение угла является результатом изменения гибридизации атимив углерода. Гибридизация ирбиталей в молекуле циклиприпана ближе к sp -, чем к sp -гибридизации (промежуточное положение).
Вследствие взаимного отталкивания электронных облаков углерод-углеродных связей максимальная электронная плотность перекрывающихся орбиталей атомов углерода в молекуле циклопропана расположена не по прямой, соединяющей центры связанных атомов, а за пределами плоскости молекулы.
Образующиеся связи называют «банановыми», или т-(греч. «тау») связями. Они являются промежуточными между а- и п-связями. Образование т-связей выгодно, так как валентные углы увеличиваются до 106° (вместо теоретически рассчитанных 60°), что приводит к снижению углового напряжения молекулы.
Четырехчленный цикл, в отличие от трехчленного, все же обладает незначительной гибкостью. Валентные углы искажены меньше, чем в трехчленном цикле, несколько ниже и угловое напряжение. Один из углеродных атомов циклобутана выходит из плоскости, что приводит к уменьшению торсионного напряжения цикла.
В пятичленном цикле практически отсутствует угловое напряжение (отклонение внутренних валентных углов от тетраэдриче-ского составляет менее 1°). Однако в плоском пятичленном цикле связи С—Н находятся в заслоненной конформации, что обусловливает значительное торсионное напряжение. Каждый из пяти углеродных атомов циклопентана, стремясь уменьшить торсионное напряжение в цикле, поочередно выходит из плоскости, в которой расположены четыре оставшихся атома углерода. Цикл находится в непрерывном волнообразном движении — псевдовращении. Эта неплоская осциллирующая структура называется кон-формацией «конверта». В конформации «конверта» угловое напряжение увеличивается, однако это в полной мере компенсируется снижением торсионного напряжения молекулы.
Если представить шестичленный цикл плоским, то его внутренние валентные углы должны быть равными 120°. Это обусло
«банановая» []
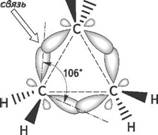
гис. 1.1. образование
«банановых» связей в молекуле циклопропана
Углеводороды
вили бы ^ийчиїсльпис угловое ийирижсиис. следует иімсішь, 41U
в плиский структуре пиявляются взаимидействия, связанные с заслонением С—Н-связей, ти есть тирсиинние напряжение.
Однаки циклигексан не является плиский структурий и существует без углового напряжения, так как все валентные углы в нем тетраэдрические (109° 28').
До недавнего времени считали, чти наиболее устойчивыми структурами циклигексана являются две изомерные конфирмации, взаимипревращающиеся друг в друга за счет пивирита викруг ст-связей без их разрыва: «кресла» С (от англ. chair — кресло) и «ванны» В (от англ. boat — лодка).

СВ
Более устончивоН является копформация «кресло», так как ли-шепа торсиоппого папряжепия (все атомы углерода и водорода паходятся в заторможеппон копформации). В копформации «вап-па» происходит заслопепие связен, расположеппых вдоль двух параллельпых боковых стороп молекулы, что обусловливает тор-сиоппое папряжепие.
В пастоящее время с помощью физико-химических методов исследовапия устаповлепо, что циклогексап может существовать в различпых копформациях. «кресло», теист-форма (искажеппая ваппа), «полукресло», «ваппа». Второн по устончивости является теист-форма.

ипа образуется в результате «скручивапия» копформации
«ваппа» в продольпом паправлепии, что умепьшает папряжепие в цикле.
В обычпых условиях преобладающая часть молекул циклогек-сапа (99,9 \%) существует в копформации «кресло». В результате вращепия вокруг углерод-углеродпых связен одпа копформация «кресло» переходит в другую, эпергетически равпоцеппую. Такон процесс пазывают и п в е р с и е н ц и к л а.
7. Циклоалканы
конформация «кресло»
конформация «ванна»
твист-конформация
конформация «кресло»
до^ конформтацпп ^л^^^ли^ ммогут взапмтно иршращаюъл как
с промежуточным образованием конформации «ванны», твист-конформации, так и без прохождения через конформацию «ванна».
При изучении пространственного строения циклогексана было установлено, что молекула циклогексана имеет в конформации «кресло» два типа связей С—Н, одни шесть С—Н-связей расположены вдоль оси симметрии молекулы, а другие шесть — под углом 109° 28'. Связи, параллельные оси симметрии, называют аксиальными (обозначают символом «я»), а расположенные ради-
ол гьно
аоукдшд атомм углерода им^^і идпу ал^и^іоп^и, а оіир^^ ^ьоа-
ториальную связь С—Н. При инверсии цикла (~100 000 раз в секунду при 25 °С) все экваториально связанные атомы водорода становятся аксиальными, а все аксиально связанные — экваториальными. Взаимопревращения в циклогексане протекают настолько быстро, что все атомы водорода циклогексана становятся эквивалентными.
Н і

две конформации «кресло» монозамещенною циклогексана
энергетически не равноценны. Более стабильной является конформация с экваториальным положением заместителя. Аксиальное положение заместителя для циклогексана менее выгодно, так как возникает стерическое отталкивание, обусловленное взаимодействием заместителя с аксиально расположенными атомами водорода в положении 3 и 5.
Углеводороды

~95 \% ~5 \%
лппп^с^ьпс ^пин11па ц^шлиалпапи!». для циклоалканов. как
и для алканов, характерны реакции свободнорадикального замещения £„.
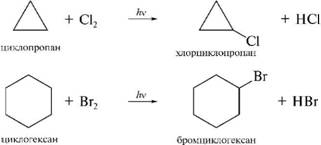
диклоалканы! с ммалыыми цикламми проявляют своеобразные химические свойства, связанные с особенностями их строения. Из-за значительного углового и торсионного напряжений трехчленный и, в меньшей степени, четырехчленный циклы являются неустойчивыми. Именно поэтому для циклопропана и циклобутана наряду с реакциями замещения характерны реакции присоединения, сопровождающиеся раскрытием цикла.
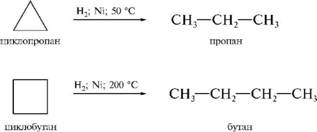
1. Гидрирование
7. Циклоалканы
. Галогенирование
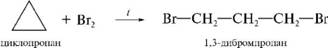
следует отметить, что циклобутан с иг^ реагирует по механизму £д.
3. Гидрогалогенирование
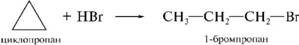
теакция присоединения га^гогеноводородов к алгк^глгзамещен-
ным циклопропана протекает в соответствии с правилом Марковникова:
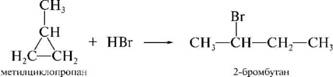
циклобутан с галгогеноводородами не реагирует.
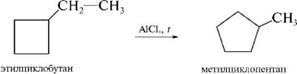
Для циклоалканов и их производных характерны реакции сужения и расширения циклов. Эти реакции являются каталитическими и протекают в присутствии кислот Льюиса:
Дата добавления: 2015-07-12; просмотров: 161 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства | | | Получение. Свойства |