
Читайте также:
|
Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,140 нм.
Это расстояние является средним значением между величинами 0,154 нм (длина одинарной связи) и 0,134 нм (длина двойной связи).
Однако не только углеродные атомы, но и связанные с ними шесть атомов водорода лежат в одной плоскости.
Углы образованные связями С-С-С и Н-С-С равны 1200.
Атомы углерода в молекуле бензоле находятся в состоянии sp2-гибридизации.
При этом три гибридизованные орбитали образуют обычные σ-связи (две С-С и одну С-Н), а четвертая – негибридизованная 2р-орбиталь перекрывается с 2р-орбиталями двух соседних углеродных атомов:

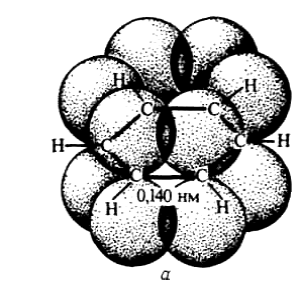
Рисунок 2 - Взаимное перекрывание 2р-орбиталей в молекуле бензола:
а - вид сбоку; б - вид сверху
В отличие от алкенов у бензола электроны π-связей не заключены в областях между каждой парой атомов углерода, а равномерно распределены по всем шести углеродным атомам, т.е. делокализованы.
В результате шесть делокализованных π-электронов, находясь на гантелеобразных орбиталях, оси которых перпендикулярны плоскости бензольного кольца, образуют единую устойчивую замкнутую циклическую π-систему, электронное облако которой расположено под и над плоскостью бензольного кольца.

Рисунок 3 - Равномерное распределение π-электронной плотности в
молекуле бензола в виде двух соприкасающихся «бубликов» (торов)
В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит «выравнивание» простых и двойных связей, т.е. в молекуле бензола отсутствуют классические двойные и одинарные связи.
Дата добавления: 2015-07-12; просмотров: 90 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Развитие представлений о строении бензола. Формула Кекуле. | | | АЛЛЕН Джеймс |