
Читайте также:
|
Медь Cu и ее электронные аналоги - серебро Ag и золото Au – являются элементами побочной подгруппы первой группы периодической системы элементов Д.И. Менделеева. Электронная структура атомов элементов подгруппы меди может быть выражена формулой …(n-1)d10s1, где n – номер внешнего электронного слоя, совпадающий с номером периода в периодической системе.
Наличие одного неспаренного электрона во внешнем электронном слое атома 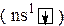 объясняет одновалентное состояние рассматриваемых металлов. Причем соединения серебра (I) являются единственно устойчивым для этого элемента.
объясняет одновалентное состояние рассматриваемых металлов. Причем соединения серебра (I) являются единственно устойчивым для этого элемента.
Энергетический подуровень (n-1)d предвнешнего электронного слоя в атомах Cu, Ag и Au должен быть заполнен девятью электрона …(n-1)d9ns2. «Провал» электрона из внешнего слоя в предвнешний …(n-1)d10ns1 способствует завершению построения подуровня (n-1)d, но еще не обеспечивает его стабильности. «Провалившийся» электрон в отличие от остальных спаренных электронов подвижен и может при возбуждении атома переходить во внешний электронный слой:
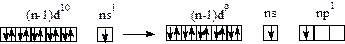
Поэтому для меди, серебра и золота типичны также двух- и трехвалентные состояния. Наиболее устойчивы соединения меди, в которых она имеет степень окисления +2 (CuO, CuSO4 и др.) и соединения золота, в которых степень окисления его +3 (AuCl3 и др.).
Медь, серебро и золото представляют собой металлы соответственно красного, белого и желтого цвета. Все они (особенно Au) характеризуются исключительной пластичностью.
Таблица 1 Некоторые характеристики элементов подгруппы меди
| Элемент | Электронные формулы последнего и предпоследнего слоев | Радиус атома, нм | Энергия ионизации, эВ | Степени окисления | Температура плавления, С0 | Плотность, г/см3 |
| Cu | …3d104s1 | 0,128 | 7,72 | +1,+2 | 8,96 | |
| Ag | …4d105s1 | 0,144 | 7,57 | +1 | 960,8 | 10,50 |
| Au | …5d106s1 | 0,144 | 9,22 | +3 | 19,32 |
Медь по электрической проводимости уступает только серебру. В связи с этим около 40% всей добываемой меди идет на изготовление электрических проводов и кабелей. Этой области применения металла способствуют исключительная пластичность и тягучесть меди. Из нее можно вытянуть проволоку диаметром 0,001 мм. У всех металлов подгруппы меди положительные стандартные электродные потенциалы, что свидетельствует об их низкой химической активности. В ряду напряжений все три металла располагаются правее водорода.
Медь – биогенный элемент, содержится в тканях животных и растений. Общая масса меди в организме взрослого человека примерно 100 мг. Ежедневно организму требуется 2,5 – 5,0 мг меди. Медь необходима для усвоения железа, в частности, при синтезе цитохромоксидазы, которая содержит и железо, и медь. При дефиците меди нарушается нормальное развитие соединительных тканей и кровеносных сосудов. Широкое применение меди и ее соединений в промышленности и сельском хозяйстве повышает риск отравления этими веществами. Отравления обычно связаны со случайной передозировкой инсектицидов, вдыханием порошка металла, заглатыванием растворов солей меди. Большую опасность представляют напитки, хранящиеся в медных сосудах без защитного покрытия стенок.
В организме взрослого человека обнаруживается около 1 мг серебра и до 10 мг золота. Антисептические свойства растворимых солей серебра известны с древних времен. В настоящее время это свойство «серебряной» воды используется моряками в дальних плаваниях. Токсичное действие соединений серебра, обусловлено тем, что ионы серебра взаимодействуют серо- и азотсодержащими группами белков, нуклеиновых кислот и других биоорганических веществ.
Механизм токсического действия соединений аналогичны механизму токсического действия соединений меди и серебра. В соответствии с общим правилом для тяжелых металлов одной группы токсичность возрастает с увеличением атомного номера в ряду: Cu, Ag, Au.
Дата добавления: 2015-07-12; просмотров: 192 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Упражнения и задачи | | | Лабораторная работа №13 |