
|
Читайте также: |
Молекулярно-генетический анализ (foot printing) Fur-регулируемых промоторов E. coli показал наличие в них 19-членного палиндрома (9 -1- 9) GATAATGAT A ATCATTATC, названного Fur-боксом, с которым связывается димер белка Fur в комплексе с железом (de Lorenzo et al., 1988). Не исключено, что сайтами связывания белка Fur могут также служить 3 гексамерных повтора GATAAT (Escolar et al., 1998). У B. subtilis Fur-бокс содержит гептамерные инвертированные повторы (7 -N- 7) TGATAAT N ATTATCA (Baichoo, Helmann, 2002). Два таких повтора, раздвинутых еще на 6 нуклеотидов (7 -7N- 7), образуют последовательность, в которой содержится классический 19-членный Fur-бокс (Fuangthong, Helmann et al., 2003). Сравнительные исследования промоторов генов, регулируемых различными белками Fur у разных объектов, показали, что для эффективного связывания регуляторного белка с ДНК достаточно 50-80% сходства конкретного сайта с консенсусом Fur-бокса (Baichoo et al., 2002; Sebastian et al., 2002; Thompson et al., 2002). Общим правилом является также наличие в сайтах связывания участков, богатых основаниями А/Т.
В определенных случаях для оптимального связывания белка Fur с ДНК наряду с Fur-боксом требуется наличие дополнительной последовательности нуклеотидов. Например, белок Fur Anabaena 7120 неэффективно связывается с небольшой синтетической последовательностью из 27 нуклеотидов, несмотря на содержание в ней специфичного Fur-бокса (Gonzalez et al., 2011). Вместе с тем известен случай неспецифического взаимодействия белка Fur с промотором гена irr (Fur-бокс отсутствует) у Bradyrhizobium japonicum (Friedman, O’Brian, 2003). Однако в целом следует отметить, что у разных представителей суперсемейства FUR сайты узнавания в ДНК характеризуются заметным сходством (Fuangthong, Helmann, 2003).
2.4. Белок Fur – больше чем глобальный регулятор транскрипции
Выявление все большего количества генов, экспрессия которых контролируется белком Fur у разных видов бактерий, свидетельствует о его роли в качестве глобального регулятора. При этом многие гены предполагаемых Fur-регулонов кодируют гипотетические белки с неизвестными функциями. Способность белка Fur взаимодействовать с гемом и другими сигнальными молекулами, такими как NO и CO, указывает на наличие у него наряду с функцией регулятора транскрипции и других клеточных функций (Igarashi et al., 2011; Pellicer et al., 2012). Не исключено, что он может служить также сенсором редокс-статуса клетки (Botello-Morte et al., 2014). Поскольку потенциально белок Fur взаимодействует in vivo с белками, реагирующими на окислительный стресс, предполагают, что он участвует в транспорте электронов, в частности, у цианобактерий (Fillat, 2014).
Роль белка Fur в гомеостазе железа, в контроле вирулентности и в адаптивных ответах клетки
Белки Fur контролируют метаболизм железа у подавляющего большинства прокариот за исключением ряда грамположительных бактерий, например, Mycobacterium spp., и архей, у которых такой контроль осуществляют белки семейства DtxR (Gold et al., 2001; Hantke, 2001; Andrews et al., 2003; Louvel et al., 2009; Zhu et al., 2013). В аэробных условиях железо находится в труднорастворимой окисленной трехвалентной форме, и для ассимиляции трехвалентного железа, часто представленного в среде в следовых концентрациях, бактерии используют высоко аффинные внеклеточные хелаторы железа, называемые сидерофорами (Zhu et al., 2013). В настоящее время генетический контроль транспорта железа, как в свободном виде, так и в комплексе с сидерофорами, довольно хорошо изучен, особенно у E. coli. Показано, что в условиях достатка железа белок Fur репрессирует гены транспорта двухвалентного железа и гены белков Bfr, FtnA и FtnB, участвующих в его запасании. Более того, он репрессирует все гены биосинтеза и транспорта сидерофоров, включая их рецепторы Cir, FecA, FepA, FhuA, FhuE и Fiu в наружной мембране и АВС-транспортеры FecBCDE, FepBCDEFG и FhuBCD в цитоплазматической мембране (Earhart, 1996).
Поскольку основным препятствием развития патогенных бактерий в организме-хозяине является низкая концентрация железа, гены систем транспорта железа служат для них истинными факторами вирулентности, а регулирующий их ген fur – ассоциированным фактором вирулентности. В качестве примера можно привести fur -зависимый кластер генов Staphylococcus aureus, который содержит 7 генов (isdA-G), кодирующих белки транспорта и деградации гема, и ген сортазы (srtB), прикрепляющей наружные белки-транспортеры к клеточной стенке (Marraffini et al., 2008). Выяснение роли белка Fur в контроле вирулентности патогенных бактерий является актуальной задачей современных исследований (Carpenter et al., 2009; Troxell et al., 2013). В частности, показано его участие в регуляции продукции токсинов бактериями Vibrio spp. (Kim et al., 2013; Mey et al., 2005), P. aeruginosa ( Ochsner et al., 1995) и Legionella pneumophila (Allard et al., 2006), а также цианобактерией Microcystis aeruginosa (Sevilla et al., 2008). Установлено, что нормальное функционирование гена fur у H. pylori необходимо для успешной колонизации клеток модельных организмов, таких как песчанка и мышь (Bury-Mone et al., 2004; Gancz et al., 2006), а дефект этого гена у Campylobacter jejuni приводит к невозможности колонизировать желудочно-кишечный тракт цыпленка (Palyada et al., 2004). Нарушение экспрессии гена fur является причиной ослабленной вирулентности мутантных штаммов S. aureus (Horsburgh et al., 2001; Torres, et al., 2010), Listeria monocytogenes (Rea et al., 2004) и V. cholerae (Mey et al., 2005). С помощью молекулярно-генетического анализа (ДНК-микроэррэй в сочетании с футпринтингом) выявлен спектр Fur-регулируемых генов, связанных с вирулентностью штаммов N. meningitidis и N. gonorrhoeae (Yu, Genco, 2012). Установлено, что белок Fur вовлечен в нейтрализацию активных форм кислорода, вырабатываемых клетками организма-хозяина, а также в устойчивость к кислотам у Salmonella typhimurium (Hal et al., 1996; Gancz et al., 2006), в контроль усвоения рибофлавина у C. jejuni (Crossley et al, 2007)и устойчивость к осмотическому стрессу у Desulfovibrio vulgaris (Bender et al., 2007). У представителей рода Pseudomonas белок Fur связан с формированием биопленок (Banin et al., 2005) и регуляцией чувства кворума, опосредованной некодирующими РНК PrrF1 и PrrF2 (Oglesby et al., 2008), а у P. рseudoalcaligenes участвует в контроле дыхания и обуславливает резистентность к действию цианидов (Becerra et al., 2011). Предполагается, что у Shewanella piezotolerans белок Fur служит сенсором бескислородных условий, косвенно регулируя анаэробное дыхание через белок ArcА (Yang et al., 2013).
У азотфиксирующей цианобактерии Anabaena 7120 белок Fur является основным регулятором гомеостаза железа, а также непосредственно контролирует многие гены, вовлеченные в фотосинтез, дыхание и адаптивный ответ на окислительный стресс (Gonzalez et al., 2010, 2011,2012). Правильная экспрессия гена fur требуется для полной дифференциации гетероцист (Gonzalez et al., 2013); причем, уровень экспрессии этого гена в гетероцистах значительно выше, чем в делящихся клетках, что, возможно, связано с анаэробиозом (Lopez-Gomollon, Hernandez et al., 2007). Следует также отметить, что экспрессия всех генов, вовлеченных в метаболизм азота, координируется белком Fur и белком NtcA, главным регулятором метаболизма азота у цианобактерий (Lopez-Gomollon, Pellicer et al., 2007).
В совокупности представленные данные свидетельствуют о существенной и, возможно, центральной роли белка Fur в метаболизме прокариот, реализующейся через модуляцию экспрессии множества генов, вовлеченных в различные процессы и адаптивные ответы клетки.
Механизмы репрессии и активации экспрессии генов белком Fur
Исходно полагали, что белок Fur функционирует сугубо как репрессор транскрипции, использующий в качестве кофактора ионы Fe2+ (Bagg, Neilands, 1987). Однако все больше фактов свидетельствует о возможности прямого или непрямого позитивного контроля генов белком Fur, а также контроля транскрипции им в апо-форме. У E. coli давно выявлена позитивная регуляция геном fur экспрессии ряда генов железосодержащих белков, в частности, бактериоферритина Bfr и супероксиддисмутазы Fe-SOD (Niederhoffer et al., 1990). В данном случае активация транскрипции опосредована репрессией голобелком Fe2+-Fur гена антисмысловой регуляторной РНК RyhB (Masse et al., 2002; McHugh et al., 2003), синтезирующейся соответственно только в условиях недостатка железа и связывающейся с комплементарным участком мРНК негативно регулируемых ей генов-мишеней (Braun, Hantke, 2007). Вместе с тем описан прямой негативный контроль транскрипции апобелком Fur, обнаруженный у патогенной бактерии H. pylori, у которой также наблюдали нарушение синтеза некоторых железосодержащих белков, в том числе Fe-SOD, вследствие инактивации гена fur (Delany et al., 2001). В этом случае экспрессия ортолога гена sodB (Fe-SOD) у H. pylori, в отличие от E. coli, была подвержена непосредственной репрессии белком Fur в отсутствии железа. Позже транскриптомный анализ предсказал наличие у H. pylori апо-Fur-регулона, состоящего из 16 генов, кодирующих белки, участвующие в хранении железа, дыхании, энергетическом обмене и хемотаксисе (Lee et al., 2007).
Хотя вопрос о регуляции генов апобелком Fur у H. pylori остается дискуссионным, существуют экспериментальные указания на то, что в такой форме он регулирует не только гены железосодержащих белков (sodB и prf), но и гены белков, не содержащих железа, например, ген цитохрома c553, содержащего медь (Carpenter et al., 2013). Репрессия некоторых генов апобелком Fur в отсутствие железа отмечена также у D. vulgaris Hildenborough (Bender et al., 2007) и N. gonorrhoreae (Yu, Genco, 2012). Рентгеноструктурный анализ апоформы Fur C. jejuni показал, что в данном случае ДНК-связывающий домен белка развернут на 180° относительно его положения в голодимерах Fe2+-Fur других видов (Butcher et al., 2012). Такое различие голо- и апоформ регулятора Fur может указывать на узнавание ими различных последовательностей в промоторах генов-мишеней (Fillat, 2014). Более того, было показано, что апобелок Fur играет роль не только репрессора, но и активатора транскрипции у бактерий C. jejuni (Butcher et al., 2012), N. Gonorrhoeae (Grifantini et al., 2003)и H. pylori (Carpenter et al., 2013). Как и в V. vulnificus, S. typhimurium и многих других апо-форма активирует fu r (Lee et al., 2007), регулируемый железом белок IRO-28 (Hall et al., 1996), а также ген множественной лекарственной устойчивости norA у S. aureus (Deng et al., 2012 ).
Активация генов голобелком Fe2+-Fur может осуществляться разными путями, в основном еще мало изученными. Прямая активация может быть связана с конкуренцией между белком Fur и другим репрессором. Так происходит с геном norB, в промоторе которого белок Fur препятствует связыванию репрессора ArsR с сайтом, перекрывающимся с Fur-боксом (Isabella et al., 2008). У E. coli описан механизм опосредованной активации, когда белок Fur сдвигает структурирующий белок, связанный с промотором гена ftnA, открывая, таким образом, доступ РНК-полимеразе (Nanda et al., 2010). Между тем механизм прямой активации транскрипции с участием белка Fur представляется более широко распространенным. Комплекс Fe2+-Fur активирует экспрессию гена бактериоферритина bfrB у P. aeruginosa (Wilderman et al., 2004), гена порина OmpT наружной мембраны у V. cholerae (Craig et al., 2011) и гена вирулентности hilD у S. typhimurium (Teixido et al., 2011). У Anabaena 7119 белок FurA играет двойную роль в регуляции транскрипции генов тетрапирольного пути биосинтеза, выступая, с одной стороны, в качестве зависимого от железа репрессора генов hemB, hemC и ho1, а с другой – в качестве зависимого от железа активатора генов hemK и hemH (Gonzalez et al., 2012). Анализ тотального профиля транскрипции у мутанта N. meningitidis с делецией гена fur выявил 38 Fur-активируемых генов (Delany et al., 2006), входящих в состав еще большего числа Fur-зависимых генов, связанных с контролем транспорта и запасания железа, энергетического обмена и адаптивных ответов (Yu, Genco, 2012). Среди 59 генов Fur-регулона H. pylori выявлено 25 позитивно регулируемых генов, включая ген основного флагелина flaB и гены HP0295, fliY, flgK и cheA, контролирующие хемотаксис (Danielli et al., 2006). Последующие исследования также выявили прямую Fur-зависимую активацию гена nifS (Alamuri et al., 2006), генавирулентности cagA (Pich et al., 2012) и генов оперона oorDAB C (Gilbreath et al., 2012). У E. coli Fur-активируемыми оказались гены энергетического обмена, в основном гены железосодержащих белков дыхательных комплексов (McHugh et al., 2003).
Таким образом, активация транскрипции генов белком Fur существенно распространена у различных представителей прокариот. Однако в определенных случаях активация не является прямой, а опосредуется репрессией голобелком Fe2+-Fur небольших регуляторных РНК. Открытие первой из таких некодирующих РНК, RyhB, объяснило механизм активации гена железосодержащей супероксиддисмутазы (Fe-SOD) у E. coli и показало, что РНК RyhB тем же способом опосредует Fur-регуляцию генов acnA, fumA и bfr (Masse, Gottesman, 2002). Вместе с тем это открытие вскрыло механизм взаимосвязи между снижением содержания железа в среде и замедлением зависимых от железа метаболических процессов (механизм, названный ответом «запасания железа»). Представления о роли малых некодирующих РНК в регуляции генов белком Fur значительно расширились после обнаружения ортологов RyhB у большого числа бактерий различных родов (http://rfam.xfam.org/family/RyhB#tabview=tab1), таких как Shigella, Enterobacter, Klebsiella, Citrobacter и Salmonella, а также у V. cholerae и Yersinia pestis (Oglesby-Sherrouse et al, 2013). Более того, у многих бактерий найдены негомологичные функциональные аналоги РНК RyhB. У грамотрицательных бактерий к таким РНК относятся PrrF1 и PrrF2 P. aeruginosa (Wilderman et al., 2004), NrrF и ArrR Neisseria spp. (Mellin et al., 2007; Ducey et al., 2009; Metruccio et al., 2009) и Azotobacter vinelandii (Jung, Kwon, 2008); а у грамположительных, например у B. subtilis – РНК FsrA (Gaballa et al., 2008). Недавно проведенный полногеномный анализ девяти протеобактерий выявил 38 некодирующих РНК, контролируемых белком Fur, что указывает на широкую распространенность такого механизма непрямой Fur-зависимой регуляции (Sridhar et al., 2013).
Белок Fur в качестве сенсора редокс-статуса клетки
Изменения в содержании железа неизбежно отражаются на редокс-потенциале клетки, поэтому тонкая регуляция метаболизма железа является жизненно важной. Известно, что повышенная экспрессия гена fur может приводить к развитию окислительного стресса (Zheng et al., 1999; Lopez-Gomollon et al., 2009), в связи с чем окисление остатков цистеина в белке Fur, как было установлено у цианобактерий и представителей рода Streptomyces, может иметь адаптивное значение (Fillat, 2014). Показано, что у S. reticulii от состояния остатков цистеина зависит функция белка FurS, который, как и регулятор ответа на окислительный стресс PerR, активируется и ионами Fe2+, и Mn2+ (de Orue et al., 2000). Однако в целом вопрос о восприятии белком Fur окисления в качестве физиологического сигнала мало изучен (Spiro, D’Autreaux, 2012). Существуют организмы, у которых не идентифицированы ортологи белка PerR, и функцию регулятора ответа на окислительный стресс у них выполняет паралог белка Fur. Так, у Anabaena 7120 белок FurA регулирует экспрессию ряда генов, которые у других организмов находятся под контролем белка PerR; более того, активность FurA явно связана с редокс-потенциалом клетки (Hernandez et al., 2004; Hernandez et al., 2006).
Известно, что белки Fur взаимодействуют с гемом, который катализирует образование АФК и сам служит сигналом окислительного стресса. В качестве кофактора гем связывается с гистидиновыми или цистеиновыми остатками в составе белков и в дополнение к своим редокс функциям может работать как сенсор различных газов, таких как O2, NO или CO (Igarashi et al., 2011). При этом у большинства бактерий белок Fur контролирует гены, ответственные за поглощение и деградацию гема. Благодаря высокому сродству к димеру Fur у E. coli молекула гема препятствует встраиванию в активный центр белка цинка или марганца (Smith et al., 1996). Другой тип взаимодействия с гемом, при котором белок Fur утрачивает сродство к ДНК, описан у цианобактерии Anabaena 7120 (Hernandez et al., 2004). В данном случае белок Fur содержит специфический цистеин-пролиновый участок, связывающий гем. Спектроскопический анализ подтвердил роль цистеина в качестве одного из аксиальных лигандов гема, а также редокс-чувствительного триггера (Pellicer et al., 2012). Таким образом, гем служит редокс-сигналом у Anabaena 7120. В настоящее время исследуется его способность посредством белков Fur регулировать анаэробное дыхание (Teixido et al., 2010; Yang et al., 2013).
Окислительный стресс – особая проблема фотосинтезирующих организмов, у которых железо-серные белки обоих фотосистем богаты лабильными кофакторами. У нитчатых азотофиксирующих цианобактерий эффективные пути передачи редокс-сигналов необходимы не только в вегетативных клетках, но и в гетероцистах, где активность нитрогеназы требует соблюдения анаэробных условий. Современные данные свидетельствуют о том, что существенную роль в редокс-гомеостазе нитчатой цианобактерии Anabaena 7120 играет белок FurA, у которого, помимо функции транскрипционного фактора, предполагается активность дисульфидредуктазы (Fillat, 2014). Такая ферментативная активность белка FurA, несвойственная его ортологам у гетеротрофных организмов, таких как L. monocytogenes и H. pylori, была подтверждена экспериментами in vitro (Botello-Morte et al., 2014). Как и другие представители своего семейства, белок FurA содержит два мотива CXXC, подобные которым имеются в составе тиолдисульфидоксидоредуктаз и тиоредоксин-подобных белков. Кроме того, остатки цистеина (С) в обоих участках белка FurA соседствуют с остатками лизина, стабилизирующими тиольные группы цистеина (Benoit, Auer, 2011). В отличие от своих известных ортологов, белок FurA не связывается с цинком, что, вероятно, обуславливает его способность реагировать на редокс-статус клетки (Botello-Morte et al., 2014). Данная способность белка FurA предполагает образование в его окисленном состоянии внутримолекулярной дисульфидной связи. Таким образом, ранее неизвестная редокс-активность белков семейства Fur еще больше расширяет современные представления о разнообразии их регуляторных функций.
2.5. Перекрывание регулонов и контроль экспрессии гена fur
Белок Fur совместно с другими транскрипционными факторами вовлечен в перекрестную регуляцию многих генов, в том числе генов этих факторов и самого гена fur, что значительно расширяет спектр Fur-зависимых метаболических путей и адаптивных ответов клетки. Контроль экспрессии гена fur, как при его авторегуляции, так и регуляции другими генами, а также в ответ на различные воздействия, в настоящее время активно изучается и представляется сложным и варьирующим у разных объектов. Известно, что недостаток железа стимулирует экспрессию гена fur у большинства энтеробактерий, цианобактерий и грамположительных бактерий. Кроме того, на экспрессию этого гена влияют окислительный стресс, изменение pH, метаболизм углерода и азота. Например, у E. coli активность гена fur определяется взаимодействием многих факторов, основными из которых являются доступность железа и окислительный стресс; при этом главные регуляторы стрессового ответа, OxyR и SoxS, активируют его экспрессию (Zheng et al., 1999). В связи с тесной связью гомеостаза железа с окислительным стрессом у многих организмов белок Fur вовлечен в адаптивный ответ на пероксид водорода через активацию регуляторных генов perR и oxyR. С другой стороны, как в случае S. aureus, зависимый от марганца репрессор PerR наряду с собственным геном контролирует ген fur, а также гены железо-запасающих белков и гены антиоксидантной защиты (Horsburgh et al., 2001). Вместе с тем обнаружено функциональное взаимодействие между белком Fur и белком Crp, который регулирует углеродный метаболизм, взаимосвязанный с метаболизмом железа у E. coli (Zhang et al., 2005). Молекулярно-генетический анализ свидетельствует о взаиморегуляции белка Fur и небольшого белка Crl, обуславливающего сродство белка Fur к промотору собственного гена. Более того, с белком Crl взаимодействует ассоциированный со стрессом голодания сигма-фактор RpoS; поэтому триаду RpoS-Crl-Fur рассматривают в качестве ключевого элемента регуляции общего стрессового ответа (Lelong et al., 2007).
Следует отметить, что зависимость экспрессии гена fur от железа сильно варьирует у разных организмов. Например, у H. pylori ген fur подвержен тонкой регуляции в ответ на содержание железа благодаря наличию в его промоторе трех операторов, с которыми связывается белок Fur. При этом важнейшее значение имеет дистальный оператор, связывающий белок Fur в апо-форме, которая соответственно не несет ион железа и необходима для инициации транскрипции гена fur (Delany et al., 2003). В кислой среде, повышающей растворимость и доступность железа, усиливается авторепрессия этого гена, вследствие чего происходит адаптивная дерепрессия fur -зависимых факторов вирулентности,обуславливающих кислотоустойчивость у H. pylori (Bijlsma et al., 2002). Диаметрально противоположный пример представляет ген fur P. aeruginosa, оба независимых промотора которого не содержат Fur-боксов и не зависят от железа (Vasil, Ochsner, 1999). Практически не зависит от железа экспрессия ортологов fur у двух других грамотрицательных патогенных бактерий Burkholderia pseudomallei (Loprasert et al., 2000) и C. jejuni (van Vliet et al., 2000). Имеются также противоречивые сведения о гене fur холерного вибриона V. cholerae. Согласно одним данным, экспрессия этого гена слабо зависит от железа (Litwin et al., 1992), а согласно другим – при недостатке железа существенно активируется сигма-фактором RpoS (Lee et al., 2003; Lee et al., 2007).
Известны примеры пост-трансляционной модуляции активности белка Fur. Показано, что у нитчатой цианобактерии Anabaena 7120 связывание белков-паралогов FurA и FurB с гемом уменьшает их сродство к ДНК (Lopez-Gomollon et al., 2009; Hernandez et al, 2004). Критичная для функции модификация белка Fur E.coli происходит при нитридном стрессе и заключается в его прямой инактивации из-за связывания кофактора Fe2+. Вероятно, комплекс Fe-Fur-NO претерпевает конформационное изменение, благодаря которому димер белка теряет способность связываться с ДНК in vitro. При этом in vivo NO вызывает дерепрессию Fur-регулируемых промоторов (D’Autreaux et al., 2002). Подобный механизм обнаружен и уграмположительных бактерий S. enterica (Crawford et al., 1998), S. aureus и B. subtilis (Richardson et al., 2006), у которых воздействие NO приводит к дерепрессии генов регулона белка Fur, а также к инактивации его железо-зависимого паралога PerR. Следует отметить, что в условиях, способствующих включению марганца в активный центр белка PerR, его регулон становится нечувствительным к NO; это указывает на то, что только в комплексе с железом этот белок является NO-чувствительным (Moore et al., 2004).
2.6. Антисмысловые РНК бактерий; потенциальная роль в регуляции гена fur
В настоящее время изучение пост-транскрипционной регуляции генов с участием некодирующих РНК (нкРНК) является одним из наиболее активно развивающихся направлений биологии. Ранее транскриптомы прокариот считали простыми, поскольку их геномы практически целиком состоят из генов, кодирующих белки, рибосомные РНК и транспортные РНК. Однако современные полногеномные исследования выявили у них масштабную транскрипцию генных и межгенных участков, а также участков ДНК, комплементарных кодирующим последовательностям (антисмысловые РНК, асРНК) (Rasmussen et al., 2009; Dornenburg et al., 2010; Mitschke et al., 2011). В целом нкРНК существенно преобладают у бактерий, как, например, у цианобактерии Synechocystis 6803, у которой они составляют до 65% всех выявленных транскриптов (Mitschke et al., 2011).
Природные асРНК были впервые обнаружены у бактерий более 30 лет назад (Itoh, Tomizawa, 1980; Lacatena, Cesareni, 1981), а для бактериофага λ постулированы еще раньше (Spiegelman et al, 1972). О первом случае антисмысловой регуляции экспрессии генов у архей стало известно в 1993 году, когда у фага jH экстремально галофильной археи Halobacterium salinarium выявили асРНК, комплементарную первым 150 нуклеотидам транскрипта T1 (Stolt, Zillig, 1993). Сначала несколько изученных хромосомных, плазмидных и фаговых асРНК прокариот считали скорее исключением, чем правилом. Однако эти примеры показали, что природные асРНК присутствуют во всех трех царствах живого, хотя в последние годы их исследовали в основном у эукариот. Современные данные позволяют полагать, что регуляция экспрессии генов с помощью асРНК представляет собой особый уровень управления геномом.
Молекулярные механизмы действия асРНК у бактерий
В то время как знание о количестве асРНК у отдельных бактерий быстро растет, информация о молекулярных механизмах их действия накапливается значительно медленнее. Между тем хорошо изучены функциональные свойства нескольких асРНК бактериофагов и плазмид, а также многих транс-действующих нкРНК (Brantl, 2007).
Изменение стабильности РНК-мишени. Взаимодействие асРНК с РНК-мишенью приводит к изменению вторичной структуры обеих взаимодействующих молекул и образованию формы дуплексной РНК. Эти структурные изменения по-разному влияют на стабильность и период полураспада РНК. В некоторых случаях следствием образования дуплекса является быстрая и полная деградация обеих РНК. Ярким примером служит асРНК OOP длиной 77 н. фага λ, которая комплементарна 3'-концу мРНК белка CII, активатора функции репрессора CI. Сверхэкспрессия OOP приводит к расщеплению мРНК CII РНКазой III, первоначально на двух участках: один в 3'-конце кодирующей области и один в области между генами CII и О (Krinke, Wulff, 1990; Krinke et al., 1991).
Взаимоисключение асРНК и мРНК. Хорошо изученным примером кодеградации является пара IsiA/IsrR, смысловая/антисмысловая РНК Synechocystis 6803 (Dühring et al., 2006). Белок IsiA участвует в стрессовом ответе и приводит к существенной реорганизации фотосинтетического аппарата, формированию кольцевой структуры вокруг фотосистемы I (Dühring et al., 2006). Таким образом, синтез РНК IsiA должен быть подвержен строгой регуляции, которая отчасти достигается за счет асРНК IsrR (рис. 2). Эти два транскрипта накапливаются в обратной зависимости друг от друга, и, следовательно, обе РНК практически существуют в виде взаимоисключающих друг друга структур. АсРНК IsrR транскрибируется с конститутивного промотора, в то время как транскрипция гена isiA индуцируется недостатком железа, окислительным или световым стрессом. Когда присутствуют обе РНК одновременно, они образуют РНК-дуплексы, которые немедленно расщепляются по неизвестному механизму. Таким образом, информация гена isiA не может быть реализована, пока молекулы мРНК IsiA не оттитруют все молекулы асРНК IsrR. Избыточная концентрация и асРНК IsrR, и комплементарного ей участка мРНК IsiA, реципрокно приводит к разрушению соответствующего антагониста. Интересно, что сами по себе эти одноцепочечные молекулы РНК являются очень стабильными; период полураспада IsrR более 45 мин (Legewie et al., 2008). В результате асРНК IsrR вызывает не только задержку экспрессии гена isiA в ранней фазе стресса, но и быстрое истощение мРНК IsiA в период восстановления после стресса, когда транскрипция гена isiA прекращается. Такая регуляция известна как механизм "порогового линейного отклика" (Legewie et al., 2008).
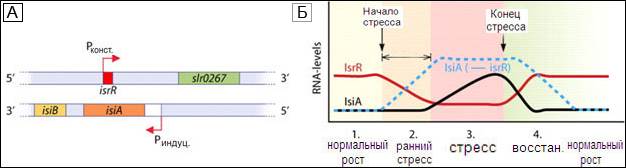
Рис. 2. Физическая карта промоторов и генов мРНК IsiA и асРНК IsrR(А), а также схема взаимоисключения этих РНК в норме и при стрессе у Synechocystis 6803 (Б). Линия-пунктир – потенциальная кривая синтеза-распада мРНК IsiA в отсутствие IsrR.Заимствовано из работ Dühring et al., 2006 (А) и Legewie et al., 2008 (Б).
Процессинг и стабилизация мРНК с участием асРНК. Взаимодействие мРНК и асРНК не обязательно приводит к их деградации. РНК-дуплекс может также генерировать специфический сайт процессинга, что приводит к поступательной инактивации мРНК, либо формированию зрелой или стабилизированной мРНК. АсРНК GadY у E. coli участвует в ответе на кислотный стресс. Ген асРНК GadY расположен в 3'-конце гена gadX, который является активатором глутамат-зависимой системы устойчивости к кислотам (Opdyke et al., 2004). АсРНК GadY контролирует уровень мРНК GadX, вызывая расщепление бицистронной мРНК GadXW. Разделенные мРНК G adX и G adW обладают повышенной стабильностью (Opdyke et al., 2011). Было показано, что в процессинг мРНК GadXW могут быть вовлечены РНКаза E (Takada et al., 2007) и РНКаза III (Opdyke et al., 2011). Не исключено, что данный пример иллюстрирует весьма распространенный механизм позитивной регуляции генов с участием асРНК.
Взаимодействие между асРНК и РНКазой Е. Описан пример защиты мРНК, с 5’-участком которой взаимодействует асРНК, от расщепления РНКазой Е in vitro (Mackie, 1998). В клетках цианобактерии Prochlorococcus MED4, инфицированной фагом P-SSP7, большинство хозяйских мРНК обладает меньшим периодом полураспада, чем в неинфицированных клетках. Вероятно, такое состояние поддерживается усилением активности хозяйской РНКазы Е, о чем свидетельствует повышенный уровень ее мРНК (Lindell et al., 2007). Интересно, что некоторые мРНК, содержание которых было повышено в инфицированных клетках, имеют большие асРНК (до 7 т.н.), которые также были индуцированы. Взаимодействие длинных асРНК с полицистронными мРНК маскировало сайты расщепления РНКазой Е и предотвращало деградацию (Stazic et al., 2011). Вместе с тем существует пример деградации мРНК РНКазой Е при участии асРНК в системе AmgR/ mgtC у S. enterica (Lee, Groisman, 2010).
Терминация транскрипции мРНК. Существуют также механизмы действия асРНК, не относящиеся к пост-транскрипционным, поскольку проявляются непосредственно на уровне транскрипции. Система транспорта железа у V. anguillarum кодируется опероном, который включает в себя четыре гена транспортеров сидерофоров (fatDCBA), два гена биосинтеза сидерофоров (angR and angT), а также две асРНК (RNAα и RNAβ). Обе асРНК негативно регулируют оперон при высокой концентрации железа (Chen, Crosa, 1996; Salinas, Waldbeser, Crosa, 1993; Waldbeser, Chen, Crosa, 1995; Waldbeser et al., 1993). В то время как асРНК RNAα подавляет экспрессию генов fatA и fatB, асРНК RNAβ определяет дифференциальную транскрипцию всего оперона fatDCBA-angRT и укорочение мРНК FatDCBA (Stork et al., 2007). АсРНК RNAβ комплементарна 3′-концу гена fatA и 5'-концу angR, и ее связывание с растущей мРНК FatDCBA приводит к терминации транскрипции на потенциальной шпильке вблизи стоп-кодона гена fatA. То же происходит при добавлении RNAβ in vitro, что исключает другие механизмы регуляции, такие как ко-деградацию или транскрипционную интерференцию (Stork et al., 2007).
Другим примером служит контроль экспрессии гена вирулентности icsA (virG) асРНК RnaG у патогенной бактерии Shigella flexneri. Эта асРНК подавляет транскрипцию, используя механизм транскрипционной интерференции. На 5’-конце мРНК IcsA образуются две длинные шпильки с функцией антитерминатора. Связывание асРНК с транскрибирующейся мРНК препятствует образованию антитерминатора и способствует образованию шпильки, терминирующей транскрипцию (Giangrossi et al., 2010).
Нарушение трансляции. В ряде случаев деградация РНК имеет второстепенное значение при подавлении экспрессии генов. Примером служит регуляция с участием асРНК SymR синтеза SOS-белка SymE энтеробактерий, который не синтезируется в нормальных условиях. Данная асРНК перекрывает 5’-конец мРНК SymE, в том числе сайт связывания рибосомы и стартовый кодон, и препятствует инициации трансляции (Kawano et al., 2007). Такой тип негативного контроля возможен для многих асРНК, которые перекрывают сайт связывания рибосомы или стартовый кодон мРНК.
Активация трансляции. У цианобактерии Synechocystis 6803 идентифицирована асРНК РsbA2R, комплементарная мРНК РsbA2, кодирующей белок D1 фотосистемы II. У мутантов с инактивированной асРНК РsbA2R замедлен рост при сильном освещении и снижено содержание белка D1. Установлено, что на 5’-конце мРНК РsbA2 имеет два сайта РНКазы Е, и образование дуплекса с асРНК защищает ее от разрезания. Предполагают, что первый сайт РНКазы Е защищается асРНК, а второй – рибосомой (Sakurai, 2012).
Регуляторные функции асРНК в ответ на внешние сигналы
Известно много примеров, когда условия среды влияют на экспрессию асРНК. Уровень различных асРНК реагирует на инфицирование фагом и степень освещения у цианобактерии Prochlorococcus MED4 (Steglich et al., 2007; Stazic et al., 2011), изменяется при споруляции у B. subtilis (Silvaggi et al., 2006), реагирует на изменения в потреблении СО2, условия освещения и доступность железа у Synechocystis 6803 (Dühring et al., 2996; Georg et al., 2009; Mitschke et al., 2011). У грамположительной бактерии Clostridium acetobutylicum транскрипция асРНК MccA контролируется наличием серы, и, соответственно, эта асРНК регулирует оперон, отвечающий за метаболизм серы (André et al., 2008). АсРНК IsrR зависимо от железа контролирует экспрессию гена isiA, вовлеченного в гомеостаз железа у Synechocystis 6803 (Dühring et al., 2006). У H. pylori при нейтральном рН асРНК подавляет оперон ureAB, кодирующий уреазу, необходимую для выживания патогена в кислой среде (Wen et al., 2011).
К настоящему времени экспериментально изучено несколько асРНК, комплементарных мРНК гена fur у одноклеточных и нитчатых цианобактерий (Hernandez et al., 2006; Sevilla et al., 2011). Показано, что делеция гена асРНК α-fur у Anabaena 7120 приводит к повышению внутриклеточной концентрации железа, нарушению структуры тилакоидов и снижению эффективности фотосинтеза (Hernandez et al., 2010). Аналоги генов α-fur обнаружены у цианобактерий M. aeruginosa (Sevilla et al., 2011) и Synechocystis 6803 (Martin-Luna et al., 2011). Однако потенциальные механизмы регуляторных взаимодействий (возможно, принципиально различных) между асРНКи геном fur у цианобактерий остаются невыясненными.
Дата добавления: 2015-07-12; просмотров: 109 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Свойства связывания металлов у регуляторов гомеостаза железа Fur | | | Предмет, основной вопрос и социальные функции философии |