
Читайте также:
|
Гидролиз – это разложение веществ водой. Гидролизу подвергаются углеводы, белки, жиры; в промышленности ведут гидролиз древесины. В неорганической химии чаще приходится иметь дело с гидролизом солей.
Гидролиз солей – это обменное взаимодействие ионов соли с молекулами воды, приводящее к образованию слабого электролита и смещению равновесия электролитической диссоциации воды.
В результате гидролиза в растворе появляется избыток ОНˉ или Н+, среда становится основной или кислой. Гидролиз является результатом поляризационного взаимодействия ионов солей с их гидратной оболочкой. Чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз. Сущность гидролиза можно представить следующим образом.
Катионы соли связываются в растворе с гидратирующими их молекулами воды донорно–акцепторной связью. Донор – атомы кислорода воды, акцепторы – катионы, имеющие свободные атомные орбитали.
1) Если катионы и анионы незначительно воздействуют на  , то взаимодействие соли с
, то взаимодействие соли с  практически не происходит. Это относится к солям, образованным сильными основаниями и сильными кислотами, они гидролизу не подвергаются:
практически не происходит. Это относится к солям, образованным сильными основаниями и сильными кислотами, они гидролизу не подвергаются:  .
.
Равновесие диссоциации воды при этом не нарушаются и pH = 7.

2) Если соль образована катионом сильного основания и анионом слабой кислоты (  ), то происходит гидролиз по аниону.
), то происходит гидролиз по аниону.

Чем больше поляризующее влияние анионов, (т.е. чем слабее кислота) тем интенсивнее гидролиз.
3)Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону.
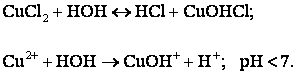
Здесь гидролиз обусловлен образованием малодиссоциирующих частиц  . Равновесие электролитической диссоциации
. Равновесие электролитической диссоциации  смещается вправо и в растворе появляется избыток ионов
смещается вправо и в растворе появляется избыток ионов  , pH < 7, среда кислая, т.е. чем слабее основание, тем полнее будет гидролиз.
, pH < 7, среда кислая, т.е. чем слабее основание, тем полнее будет гидролиз.
4) Если соль образована катионом слабого основания и анионом слабой кислоты, то идет гидролиз по катиону и по аниону.

В зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания, растворы солей этого типа могут иметь слабокислую или слабощелочную реакцию, т.е.  .
.
5) Гидролиз некоторых солей, образованных очень слабыми основаниями и кислотами, является необратимым. Это карбонаты и сульфиды хрома, алюминия и железа. Эти соединения нельзя получить в водном растворе, они гидролизуются с образованиемгидроксидов и выделением газа:
 .
.
степень гидролиза возрастает с уменьшением концентрации гидролизующегося иона.
чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
чем слабее кислота и основание, тем в большей степени соль подвергается гидролизу.
Дата добавления: 2015-09-03; просмотров: 91 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Электролитическая диссоциация воды. Водородный показатель | | | Так русские законно восстановят свой суверенитет, статус и права на русскую землю |