
Читайте также:
|
К числу лекарственных препаратов, представляющих собой «вехи» в фармакологии, относится противоязвенное средство – ранитидин (зантак);

С объемом продаж 3,5 млрд. $ в 1993 году (из более 160 млрд.) и более 2,2 млрд. $ в 1997 это лекарство в течение многих лет входило в десятку наиболее продаваемых лекарств (в 1997 г. всего лишь восемь лекарств имели объем продаж более 1 млрд. долларов).
Одно из самых тяжелых заболеваний – язва желудка – долгое время оставалось недо-ступным медикаментозному лечению. Это заболевание связано с усиленной секрецией соляной кислоты клетками желудка, и только в качестве полумер можно было рас-сматривать строгие диеты, которые прописывались язвенникам, кратковременные облегчения от приема питьевой соды и операции по резекции части желудка с пораженным участком, которые не снимали повышенную кислотность желудочного сока, а лишь отдаляли возможность прободения язвы со смертельным исходом.
До начала работ по поиску лекарственного средства от язвы желудка новые фарма-кологически активные соединения находили случайным образом среди продуктов растительного или микробиологического происхождения и среди некоторых синтети-ческих препаратов. Во всех этих случаях механизм действия особенно не изучался, не были известны ферменты или рецепторные участки белков в клеточных мембранах, на которые действовали эти вещества. Поэтому поиск оптимального соединения был очень усложнен и всегда отсутствовала уверенность в том, что применяемый препарат это и есть тот самый лучший вариант по структуре.
При разработке средства для лечения язвы желудка отправной точкой послужило обна-ружение роли гистамина в работе пищеварительной системы. Это простое вещество, образующееся из входящей в состав белков аминокислоты гистидина, участвует в регуляции многих жизненно важных процессов, но его избыток вызывает целый ряд болезненных состояний в числе которых аллергические реакции и избыточное выде-ление кислоты клетками желудка. Из двух возможных путей регуляции зависимых от гистамина процессов (блокировка его образования и блокировка его действия) исследователи фирмы Смит, Клайн и Френч (США) выбрали тот, который и привел их в конце концов к успеху. Они поставили задачу по синтезу антагониста гистамина, то есть вещества, которое связывается с предназначенным для гистамина рецептором и не вызывает такого же отклика, но в то же время не дает самому гистамину занять это место. А для этого надо было получить ряд структурных аналогов гистамина и поста-раться выявить зависимость активности новых веществ от их строения.
На основании известных к началу этих работ данных можно было предположить, что на гистамин, который присутствует во всех клетках организма, реагируют по крайней мере два типа рецепторов – Н1- и Н2-рецепторы, причем Н2-рецептор встроен в клетки стенок желудка и отвечает за секрецию ими кислоты. Это наблюдение основывалось на том, что применявшиеся в качестве антиаллергических средств антагонисты гистамина, связывающиеся с первым типом рецепторов, не влияли на кислотность желудочного сока.


Приведены формулы старого антиаллергического средства с хорошим снотворным эффектом – димедрола – и одного из современных препаратов – супрастина, у которого снотворный эффект выражен очень слабо. Возможность разделения антиаллергичес-кого и снотворного эффекта предполагает наличие третьего типа рецепторов на гистамин, локализованных в клетках центральной нервной системы (ЦНС), на которые супрастин уже не действует, а в последние годы был обнаружен и четвертый тип рецепторов на гистамин. Такие рецепторы представляют собой интегрированные в мембраны клеток белковые молекулы, которые обращенным к межклеточной жидкости активным центром связываются с гистамином и в результате вызванной этим структурной перестройки включают соответствующие ферментные системы на внут-ренней стороне клеточной мембраны. Естественным лигандом всех четырех типов гистаминовых рецепторов является гистамин, но различие в строении рецепторных белков предполагает, что для каждого из них можно найти избирательные агонисты, то есть вещества, которые вызывают точно такую же перестройку, что и естественный лиганд, или же избирательные антагонисты, т.е. вещества, которые при связывании с рецептором не приводят к активации соответствующего фермента или соответст-вующей транспортной системы.
Сейчас известно, что гистаминэргические нейроны ЦНС расположены в небольшой области гипоталамуса, но их нервные окончания проходят во все отделы мозга. Поэто-му у них очень много функций. В ЦНС гистамин уменьшает продолжительность орток-сальной фазы сна, облегчает пробуждение, стимулирует двигательную активность и половое поведение, подавляет восприятие боли, усиливает жажду. Гистамин действует не только через синапсы, но и через так называемые открытые нервные окончания. Кроме того, он попадает в межклеточную жидкость и действует как гормон. Именно такой гормональный механизм и лежит в основе стимуляции гистамином механизмов, подкисляющих желудочный сок.
Молекула гистамина при всей ее простоте имеет несколько особенностей, связанных со свойствами водящих в ее состав структурных элементов. У нее возможна таутомерия с переходом протона от одного атома азота к другому и целый ряд стабилизированных водородными связями пространственно различающихся структур:

На начальной стадии были проведены синтезы метилзамещенных гистаминов и уже здесь было получено подтверждение правильности выбранного пути:

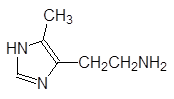
Если 2-метилгистамин избирательно связывался с Н1-рецепторами, то у 5-метил-гистамина отсутствовали все проявления гистаминной активности, кроме стимуляции выделения кислоты клетками стенок желудка, то есть он оказался агонистом гистамина в Н2-рецепторах. Стало ясно, что можно найти и антагонист.
В течение четырех лет было синтезировано более 200 соединений, но ни одно из них в используемой методике биологических испытаний не проявило антигистаминной ак-тивности. Эти испытания включали введение в анестезированнный желудок крыс гис-тамина, вслед за этим вводили исследуемое соединение и измеряли изменения рН. Один из биологов предположил, что антигистаминную активность не удается обнару-жить потому, что вводимое количество гистамина слишком мало. Дозировку гистамина увеличили для получения максимального секреции кислоты и после этого все опыты in vivo пришлось повторить. Незначительный антигистаминный эффект проявил аналог гистамина с гуанидиновой группой:

Были получены изотиомочевинные производные линейного и циклического строения, которые оказались более активными, чем предыдущее соединение:


Включение функциональной группы в цикл лишает ее подвижности. Это может приво-дить как к повышению, так и к понижению активности. В данном случае циклический аналог оказался менее активным, чем линейный.
На этом этапе к работам по поиску антагонистов гистамина подключился британский исследователь, занимавшийся до этого синтезом b-адреноблокаторов, то есть антаго-нистов адреналина в b‑адренорецепторах. Эффективные b‑адреноблокаторы были най-дены при удлинении расстояния, разделяющего аминогруппу и ароматическое ядро (приведены формулы адреналина и атенолола):
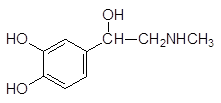

Если у адреналина ароматическое ядро и аминогруппу разделяют два атома, то у его антагониста это расстояние увеличено до четырех атомов (один атом кислорода и три атома углерода). Такое же расстояние разделяет атомы углерода и оба фенильных цикла в молекуле димедрола.
Модифицируя и удлиняя боковую цепь в молекуле гистамина и в этом случае удалось значительно повысить антигистаминную активность. Самым активным из полученных на начальном этапе исследований соединений оказался замещенный имидазол с тио-мочевинной группой, отделенной от гетероцикла четырьмя атомами углерода, получив-ший название буримамид:

У него вместо основной аминогруппы на удлиненной боковой цепи была нейтральная, но полярная тиомочевинная группировка. Полученные результаты ввиду сложности синтетического подхода к этой молекуле и не слишком высокой противоязвенной активности не представляли практического интереса и поэтому буримамид не был запатентован. Исследователи ограничились публикацией в журнале Nature.
Было сделано предположение, что для антагониста важно, чтобы таутомерное равно-весие было сдвинуто в сторону имидазольного цикла с атомом водорода у первого атома азота, а к этому, как показали спектральные исследования, приводят электроно-донорные заместители имидазольного цикла. Исследователи заменили вторую метиле-новую группу в боковой цепи на атом серы и сразу получили заметное увеличение активности. Еще больше она возросла после введения в 5‑положение гетероцикла метильной группы (5-метилгистамин также был агонистом):

Так было получено соединение, которое в 10 превосходило буримамид по фармако-логической активности. Это соединение, получившее название метиамид, можно было принимать через рот, тогда как буримамид надо было вводить парентерально. Был получен также кислородный аналог метиамида, но он оказался менее активным. Это можно объяснить тем, что у этого соединения появляется возможность образования водородной связи, которая снижает подвижность тиомочевинной функциональной группы:

В 1973 году были начаты клинические испытания метиамида, которые дали прекрас-ные результаты – при лечении этим препаратом рубцевание язвы проходило за три недели.
Метиамид стал кульминацией тщательнейших научных исследований, в ходе которых химики выявляли взаимоотношения между электронной структурой молекул, простран-ственным расположением составляющих эти молекулы атомов и их биологической активностью. Это представлялось огромным шагом в методологии дизайна лекарст-венных средств.
И все же полного удовлетворения у синтетиков не было. Они знали, что тиомочевин-ные функциональные группы относятся к токсофорным группам (нафтилтиомочевина – это крысид), то есть у них может проявиться токсичность, хотя проведенные до сих пор исследования этого и не показывали. Только из желания полностью исключить все сомнения они продолжили исследования, которые привели к новому препарату – циметидину, у которого вместо тиомочевинной группировки была цианогуанидиновая.

Это оказалось большой победой, поскольку за время последовавшего за регистрацией практического использования метиамида было все же выявлено его влияние на состав крови. У нескольких принимавших этот препарат больных было отмечено анемическое состояние, известное медикам под названием агранулоцитоз (снижение числа белых кровяных телец). Оно не носит необратимого характера и после прекращения приема лекарства состав крови приходит в норму. Но новый препарат – циметидин – был более безопасен.
Это активное начало прошло все мыслимые испытания и в кратчайшие сроки завоевало полное доверие врачей и пациентов. Разработавшая этот препарат фирма SK & F должна была организовать его производство, объем которого мог составить 1000 тонн в год, что в фармацевтической промышленности встречается не часто. Ключевой стадией здесь было превращение 4-карбэтокси-5-метилимидазола (его получают конденсацией формамида с 2-хлорацетоуксусным эфиром в молярном соотношении 2:1) с образо-ванием 4-гидроксиметил-5-метилимидазола:
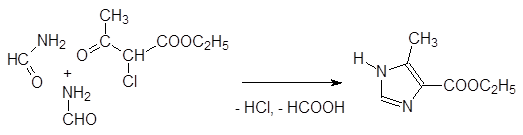

В лабораторных условиях восстановление сложноэфирной группы проводили с помощью алюмогидрида лития, но для многотоннажного производства этот реагент не годится. Он не только дорог, но его мировое производство просто недостаточно для покрытия потребности в производстве такого объема. Исследователи разработали новый способ восстановления исходного соединения натрием в жидком аммиаке, который не только был более дешевым, но и привел к более высокому выходу целевого продукта.
Далее полученный 4-гидроксиметил-5-метилимидазол конденсировали с гидрохлори-дом аминоэтилмеркаптана, а продукт реакции вводили в реакцию с S,S-диметил-N-циано-дитиоиминокарбонатом и после этого с метиламином.



Через десять лет после внедрения объем продаж циметидина превысил 1 млрд. долла-ров. Он стал самым продаваемым лекарством из тех, которые отпускаются по рецепту.
Структура циметидина продолжала совершенствоваться, и ему на смену пришел близ-кий структурный аналог ранитидин. Молекула антагониста гистамина должна, судя по всему, иметь основные свойства. У циметидина основание представлено самим имид-азольным кольцом. При переходе к другим гетероциклам пришлось вводить дополни-тельные функциональные группы. Так у ранитидина с нейтральным фурановым циклом роль основания играет диметиламинометильная группа:

Еще более эффективный фамотидин построен на основе тиазола и в дополнение к амидосульфонилзамещенной нейтральной гуанидиновой группе он имеет еще незаме-щенный гуанидиновый заместитель со свойствами сильного основания:

Появление новых более эффективных антагонистов гистамина привело к отмеченному вначале снижению выпуска самого ранитидина.
При синтезе ранитидина в качестве исходного соединения используют 2-гидрокси-метилфуран, который действием сероводорода при температуре 300-400°С на катализаторе из оксида алюминия или оксида тория превращают в соответствующий меркаптан:

Тиольную группу в этом соединении алкилируют хлорацетонитрилом:

После этого проводят аминометилирование действием диметиламина и формальдегида, восстанавливают нитрильную группу до аминометильной и замещают образовавшуюся аминогруппу 1-метиламино-1-метилмеркапто-2-нитроэтиленом с образованием ранитидина:



Лечение болезней, связанных с повышенной кислотностью желудочного сока может быть также основано на блокировке фермента, называемого подкисляющим насосом или К+,Н+-АТФ-азой. На снижении активности этого фермента основано действие лекарственного средства омепразола:

В 1997 году омепразол с 3,8 млрд. долларов лидировал в списке из восьми лекарств, объем продаж которых превышал 1 млрд. долларов. Ранитидин в этом списке был четвертым. На основе омепразола были получены также лекарства от изжоги, которые в 2006 году занимали первые строчки в числе самых продаваемых лекарств в США.
Дата добавления: 2015-10-24; просмотров: 226 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Barely Breathing | | | Краткое описание дисциплины |