
Читайте также:
|
Внутренняя энергия идеального газа зависит только от температуры U=BT где В- коэф. пропорциональности. Внутренняя энергия для 1 моля  для массы m газа
для массы m газа  Внутренняя энергия одного моля газа
Внутренняя энергия одного моля газа 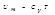 Вн. Энергия произвольной массы газа
Вн. Энергия произвольной массы газа 
27Внутрення энергия идеального газа
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул
28 Работа газа при изменении его объема
Газ оказывает давление на любую стенку сосуда. При нагревании давление газа P, будет оставаться постоянным, и, как видно из рисунка, работа, которую совершает газ, будет равна:  где dV = S dl - изменение объема газа.
где dV = S dl - изменение объема газа.  - работа, совершаемая газом при изменении его объемав) Молярная теплоёмкость газа – это количество теплоты, сообщённой 1 молю газа, для увеличения его температуры на dT.
- работа, совершаемая газом при изменении его объемав) Молярная теплоёмкость газа – это количество теплоты, сообщённой 1 молю газа, для увеличения его температуры на dT.
 - теплота, сообщённая газу для увеличения его температуры на dT.Применим первое начало термодинамики к изопроцессам в газе.Изопроцесс - это процесс, происходящий в газе, когда один из параметров, описывающих газ, является постоянным.теплоемкость для случаев, когда нагревание происходит при постоянном объеме или постоянном давлении. Для первого случая теплоемкость обозначается Cv и равна
- теплота, сообщённая газу для увеличения его температуры на dT.Применим первое начало термодинамики к изопроцессам в газе.Изопроцесс - это процесс, происходящий в газе, когда один из параметров, описывающих газ, является постоянным.теплоемкость для случаев, когда нагревание происходит при постоянном объеме или постоянном давлении. Для первого случая теплоемкость обозначается Cv и равна  , для второго случая теплоемкость обозначается Cp и равна
, для второго случая теплоемкость обозначается Cp и равна  , где i – число степеней свободы молекулы. Для изотермического процесса теплоемкость CТ = ¥, а для адиабатического процесса теплоемкость Cадиаб. = 0.
, где i – число степеней свободы молекулы. Для изотермического процесса теплоемкость CТ = ¥, а для адиабатического процесса теплоемкость Cадиаб. = 0.
гласно рассмотренной нами теории теплоемкости Cv и Cp газов должны быть целыми, кратными R/2, ибо число степеней свободы может быть только целым.
29 Количество теплоты. Теплоемкость
Количеством теплоты (Q) называется изменение внутренней энергии тела, происходящее в результате теплопередачи.
Количество теплоты измеряется в системе СИ в джоулях.
[Q] = 1Дж.
Удельная теплоемкость вещества показывает, какое количество теплоты необходимо, чтобы изменить температуру единицы массы данного вещества на 1°С.
Единица удельной теплоемкости в системе СИ:
[c] = 1Дж/кг·градусС.
Удельную теплоемкость данного вещества можно приближенно считать постоянной величиной.
У разных веществ удельная теплоемкость имеет разные значения.
Если одинаковым по массе телам из разных веществ передать одно и то же количество теплоты, то они нагреются до разной температуры. Вещество с меньшей теплоемкостью нагреется сильнее,
а вещество с большей теплоемкостью - слабее.
30 Первое начало термодинамики и его применение к изопроцессам
Первое начало термодинамики. Количество теплоты, сообщённое газу, идёт на приращение внутренней энергии газа и на совершение газом работы над внешними телами.
dQ=dU+dA - первое начало термодинамики.
Физические величины, входящие в этот закон.
а) Внутренняя энергия идеального газа равна
 , где
, где  - количество вещества, i – число степеней свободы молекул газа.
- количество вещества, i – число степеней свободы молекул газа.
Тогда изменение внутренней энергии газа равно

Изопроцессами называют термодинамические процессы, происходящие в системе с постоянной массой при каком-либо одном постоянном параметре состояния. Изотермический процесс происходит при постоянной температуре (T=const). Изохорический процесс происходит при постоянном объёме (V-const). Изобарический процесс протекает при постоянном давлении (p=const). Адиабатическим процессом называется термодинамический процесс, который происходит в системе без теплообмена с внешними телами.
Зависимость теплоёмкость ид. газа от вида процесса:
Изохорический,Изобарический,Изотермический,Адиабатический



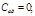
 -число молей газа, содержащихся в массе М, к-показатель адиабаты, R-универсальная газовая постоянная.
-число молей газа, содержащихся в массе М, к-показатель адиабаты, R-универсальная газовая постоянная.
31 Адиобатный процесс
Адиабатный процесс - это процесс, протекающий без теплообмена с окружающей средой.
Адиабатными можно считать быстро протекающие процессы. При быстром сжатии газа затрачивается работа, приводящая к увеличению внутренней энергии и повышению температуры. Тело, температура которого повышена, должно некоторое количество теплоты передать окружающей среде, но процесс теплопередачи требует некоторого времени, поэтому при быстром сжатии (или расширении) теплота не успевает распространиться из данного объема, то есть dQ = 0, и процесс можно рассматривать как адиабатный.
Адиабатный процесс (первое начало термодинамики):
dA = -dU.
32 Среднее число столкновений и средняя длина свободы пробега молекул
средняя дли свободного пробега - это среднее расстояние, которое проходит молекула от столкновения до столкновения.
Для определения вычислим сначала среднее число соударений выбранной молекулы с другими молекулами за единицу времени. Будем считать, что молекула после соударения продолжает двигаться по прямой со средней скоростью движения.
средняя длина свободного пробега не зависит от температуры газа, т.к. с ростом температуры одновременно возрастают и, и. При подсчете числа соударений и средней длины свободного пробега молекул за модель молекулы было принято шарообразное упругое тело. В действительности каждая молекула представляет собой сложную систему элементарных частиц и при рассмотрении упругого соударения молекул имелось в виду, что центры молекул могут сблизиться до некоторого наименьшего расстояния. Затем возникает силы отталкивания которые вызывают взаимодействие, подобное взаимодействию при упругом ударе. Среднее расстояние между центрами молекул, взаимодействующих, как при упругом ударе, называют эффективным диаметром.
Дата добавления: 2015-10-31; просмотров: 184 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Сложение гармонических колебаний одного направления и одинаковой частоты. | | | Опытные законы диффузии теплопроводности трения |