
|
Читайте также: |
Трансаминазы- специфические ферменты, которые сод-т один и тот же кофермент – пиридоксальфосфат (ПФ- производное vit B6). Трансаминаза специфична только к донорно-акцепторной связи. ПФ-источник трансаминазы и дезаминирования. Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартат и соответствующие им кетокислоты - α -кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Суммарно эти реакции можно представить в виде схемы:
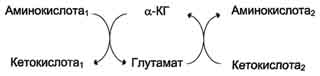
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз. Наиболее распространёнными ферментами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ), по обратной реакции - глутамат-пируватаминотрансфераза (ГПТ) и аспартатаминотрансфераза (ACT), по обратной реакции - глутамат-оксалоацетатаминотрансфераза (ГОТ).
АЛТ (АлАТ) катализирует реакцию транса-минирования между аланином и α-кетоглутаратом. Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы.
ACT (АсАТ) катализирует реакцию трансами-нирования между аепартатом и α-кетоглутаратом аналогично предыдущей. В результате образуются оксалоацетат и глутамат. ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени. Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
В результате работы аминотрансфераз аминный азот многих аминокислот переходит в состав глутамата. Есть основания считать, что накопление аминогрупп в форме глутаминовой кислоты происходит в цитозоле. Затем глутамат с помощью транслоказ попадает в митохондрии, где активна специфическая ACT. В результате действия этого фермента глутамат снова превращается в α-кетоглутарат. Последний используется для непрямого дезаминирования аминокислот, содержащихся в митохондриях. Это очень важно, так как только глутамат в тканях млекопитающих наиболее быстро может подвергаться окислительному дезаминированию (см. ниже).
Дата добавления: 2015-09-01; просмотров: 70 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общая схема источников и путей расходования аминокислот (с лекций) | | | Аминокислоты глицин и глутамат - важнейшие нейромедиаторы. |