
Читайте также:
|
": Для определения парциальных молярных величин используют аналитический (расчетный) и графический методы.
В аналитическом методе используют зависимость Xодщ =/(«,),
например, Уобщ _= а + Ъп2 + сп2 ■ •-■ ■•'■" *•'""'.- ; ■"..><;•;•--
Для определения Л',- проводят дифференцирование выражения
величины -A"06ul по переменной л,. В полученное уравнение подставляют значение га. и вычисляют парциальную молярную величину /-го компонента для раствора данного состава, например
иг о
 дп2
дп2
2сп
2 ■
(1.25)
При графическом определении парциальных молярных величин применяют два метода: метод отрезков или метод пересечений и по зависимости
где т, - моляльная концентрация растворенного вещества, моль/1000 г растворителя.
Для определения парциальных молярных величин методом пересечений строят график в координатах X -,V2. где Nj - молярная доля компонеша 2 (рис\нок 1)
| X | |||||
| ',■■■ | с | ||||
| ^"^---------------------- ~А | \ | ||||
| _____ — | X | ||||
| В" | i | ||||
| А7, | |||||
| V | \ |
(/V, =1) ЛЬ ^ (^=1)
Рисунок 1 - Определение парциальных молярных величин методом отрезков
Затем при заданном составе раствора (например, в точке А) проводят
касательную к кривой. Пересечение этой касательной с осями ординат
в точках В и С при N2 = О {N\ = 1) и Л;2 = 1 дает значения парциальных
молярных величин А1] яХ2... -v-
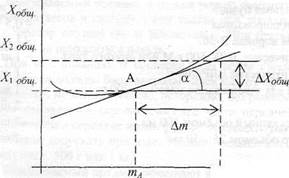
При определении парциальных молярных величин по зависимо-* сти Хо6щ = f(m.-) также строят график (рисунок 2), но в координатах
Хобщ. ~ mi при Р = const и Т= const. Проводят касательную через точку А, соответствующую заданной концентрации т4 г-го компонента. Тангенс угла наклонна касательной дает значение парциальной молярной величины компонента при выбранной его концентрации, то есть для двухкомпонентного раствора:
общ. 2оби{ Хобщ.
| tga |
| (1.26) |
| -тА |
■=А",,
где X2 - парциальная молярная величина растворенного вещества, ли:-
|
| гп\ т,, моль/1000 г р-ля |
V Рисунок 2 - Определение парциальных молярных величин
;.,,по зависимости Хобщ.=Атд - '
Если провести касательную к другой точке кривой, определить тангенс угла её наклона, то находится парциальная молярная величина растворенного вещества при другой концентрации.
В данном случае концентрация одного из компонентов (растворителя) постоянна, а другого (растворенного вещества) переменная. Из фафика определяется парциальная молярная величина только растворенного вещества. Для растворителя парциальная молярная величина вычисляется с использованием уравнения Гиббса-Дюгема (1.13).
:-■■■- И
2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ лг г к ^
Цель работы: ' '* ■ ••
Графическим методом определить парциальные молярные объё-, мы веществ двухкомпонентных водных растворов заданных моляль-ных концентраций.
Вычислить общие объёмы одного моля растворов с использованием парциальных молярных величин и по правилу аддитивности.
Вычислить функции смешения компонентов раствора. Получить уравнение для вычисления общих объёмов растворов солей в виде:
УоОЩ = Я f ЬП + СП. ~..:- -......... - -.,
Оборудование и реактивы:....;
1. Водные растворы солей MgSO4, K.2SO4, MaCl (или
других солей) концентраций - 0,05; 0,1: 0,15; 0,2 т
объёмом по. - 0,5 л
2. Фильтровальная бумага -10 шт.
3. Вода дистиллированная. - 0,5 л
4. Стеклянная воронка В-36 -1шт.
5. Весы технические ВЛК-500 г М или другого типа -1шт.
6. Весы аналитические ВЛР-200 г - 1 шт.
7. Разновесы для взвешивания массы до 200 г -■.-- - 1 компл.
8. Пинетка. - 2 шт.
9. Стакан стеклянный объёмом 100 мл '* ' -2 шт.
10. Пикнометр объемом 25...50 см" ' -2 шт.
Дата добавления: 2015-09-02; просмотров: 177 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ТЕХНИКА БЕЗОПАСНОСТИ И ПРАВИЛА ПОВЕДЕНИЯ В ЛАБОРАТОРИИ ПРИ ВЫПОЛНЕНИИ РАБОТЫ | | | Весы и взвешивание |