
Читайте также:
|
У нормі через декілька годин після їди концентрація глюкози в крові людини складає 3,33-5,55 ммоль/л. При споживанні вуглеводної їжі вона зростає до 8-9 ммоль/л, а через 2 год повертається до норми. Голодування протягом декількох діб майже не відбивається на рівні глюкози в крові.
Постійність концентрації глюкози дуже важлива з огляду на високу вірогідність порушення функцій головного мозку при гіпоглікемії. Це зумовлюється рядом обставин:
1) енергетичні потреби головного мозку забезпечуються тільки глюкозою (лише на пізній стадії голодування – кетоновими тілами);
2) запаси глікогену в головному мозку дуже незначні;
3) шляхом глюконеогенезу глюкоза в клітинах мозку не синтезується;
4) глюкоза надходить із крові в клітини головного мозку шляхом незалежної від інсуліну дифузії за градієнтом концентрації, при гіпоглікемії надходження стає недостатнім для нормального функціонування мозку. Швидкий розвиток гіперглікемї також може зумовити порушення функцій мозку.
Концентрація глюкози в крові залежить від рівноваги між надходженням її в кров і споживанням тканинами. Оскільки виведення глюкози з організму з сечею в нормі дуже незначне, то підтримка сталості концентрації у відносно вузьких межах за значних коливань надходження з їжею забезпечується процесами обміну в тканинах. Система регуляторних механізмів включає гормони інсулін, глюкагон, адреналін, глюкокортикоїди, а також взаємодії між тканинами (печінкою, м'язами, мозком тощо) (табл.).
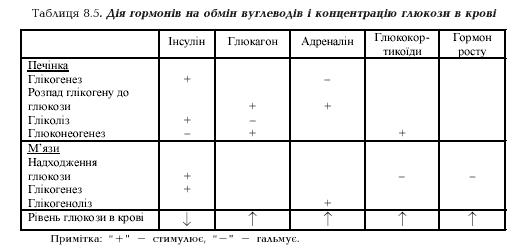
Після споживання вуглеводної їжі підвищена концентрація глюкози в крові стимулює поглинання її тканинами. Швидкість надходження в клітини печінки, м'язів, мозку й інших тканин прямо пропорційна концентрації глюкози в позаклітинній рідині. Крім того, висока концентрація глюкози в циркулюючій крові стимулює секрецію b-клітинами підшлункової залози інсуліну, який підвищує проникність глюкози через клітинні мембрани скелетних м'язів, жирової тканини.
http://www.youtube.com/watch?v=oBL0OC3IavI
У клітинах інсулін стимулює утилізацію глюкози різними шляхами:
А. У печінці й м'язах синтезується глікоген (інсулін індукує синтез глюкокінази печінки, активує гексокіназу і глікогенсинтазу).
Б. У жировій тканині й печінці глюкоза перетворюється в жирні кислоти, які утворюють тканинні резерви у вигляді тригліцеридів жирової клітковини.
В. Для всіх органів і тканин у період травлення й абсорбції катаболізм глюкози служить основним джерелом енергії. Посилюються гліколіз і аеробний розпад глюкози до СО2 і Н2О. Так, після прийому їжі наближення дихального коефіцієнта до одиниці вказує на більшу інтенсивність окиснення глюкози. Величина катаболізму вуглеводів буде залежати від потреби організму в енергії. Крім того, в цей період високе відношення інсулін/глюкагон в крові стримує глюконеогенез. У результаті концентрація глюкози в крові наближається до норми, опускаючись іноді нижче вихідного рівня. Секреція інсуліну поступово припиняється.
При припиненні надходження вуглеводів їжі концентрація глюкози в крові протягом декількох днів майже не знижується завдяки двом процесам: розпаду глікогену печінки і глюконеогенезу. Зменшення концентрації глюкози в крові до нижньої межі норми ініціює виділення підшлунковою залозою глюкагону, який активує фосфорилазу печінки. Зростають розпад глікогену і вихід глюкози в кров. Розпад глікогену печінки підтримує нормальний рівень глюкози в крові не більше 24 год, але вже через 5-6 год після прийому їжі починається повільне підвищення глюконеогенезу із амінокислот і гліцерину, а через 24 год глюконеогенез перебігає з максимальною активністю. Разом із глюкагоном, який активує ферменти глюконеогенезу, включаються глюкокортикоїди, які стимулюють синтез ферментів глюконеогенезу в печінці й посилюють розпад білків у інших тканинах, що забезпечує процес глюконеогенезу субстратами. Внаслідок низького відношення в крові інсулін/глюкагон під час голодування глюкоза не захоплюється печінкою, скелетними м'язами, міокардом, жировою тканиною. Перераховані чинники забезпечують в умовах голодування надходження глюкози в головний мозок у необхідній кількості. При тривалому голодуванні головний мозок, як і інші тканини, використовує як джерело енергії кетонові тіла.
Крім глюкагону і глюкокортикоїдів, концентрацію глюкози в крові підвищує ще ряд гормонів. Адреналін – гормон мозкової частини надниркових залоз – виділяється в стресових ситуаціях і через каскадний механізм викликає швидкий і сильний розпад глікогену печінки до вільної глюкози. Підвищенням рівня глюкози в крові супроводжується дія гормону росту, адренокортикотропіну, тироксину. Таким чином, концентрацію глюкози в крові знижує тільки інсулін, а підвищує ряд гормонів. Існування групи надійних дублюючих механізмів підкреслює той факт, що найближчі результати гіпоглікемії небезпечніші, ніж наслідки гіперглікемії.
Узгоджена дія різних гормонів зумовлює досконалість регуляції гомеостазу глюкози, забезпечує пристосування обміну вуглеводів у всьому організмі до змін харчування, фізичної активності й інших фізіологічних умов.
http://www.youtube.com/watch?v=VLiTbb6MaEU&NR=1
http://www.youtube.com/watch?v=nBJN7DH83HA&feature=related
Підвищена концентрація глюкози в крові внаслідок споживання вуглеводної їжі (аліментарна гіперглікемія) і внаслідок стресу (емоційна гіперглікемія) швидко знижується до норми. Стійка гіперглікемія може розвинутись при цукровому діабеті, який виникає в результаті абсолютної чи відносної недостатності інсуліну. Інші причини гіперглікемії – надлишкова секреція гормону росту, глюкокортикоїдів, іноді ураження ЦНС, порушення мозкового кровообігу, захворювання печінки, підшлункової залози.
Гіперглікемію при цукровому діабеті можна розглядати як корисне пристосування, яке сприяє використанню глюкози клітинами мозку, міокарда, еритроцитами, тобто інсулінонезалежними тканинами. Однак у скелетні м'язи, печінку та інші інсулінозалежні тканини глюкоза не надходить. При високій концентрації глюкози в крові підвищується швидкість зв'язування її з білками (глікозилювання білків), що зумовлює порушення їх функцій, тому тривала гіперглікемія викликає ряд віддалених ускладнень цукрового діабету
http://www.youtube.com/watch?v=ZsTSoLhl3Y4&feature=related
При діагностиці цукрового діабету кров для аналізу краще брати після голодування протягом хоча б 10 год. Концентрація глюкози в плазмі крові, взятої натщесерце, вища за 8 ммоль/л, свідчить про вірогідність цукрового діабету. Якщо концентрація глюкози знаходиться в межах 6‑8 ммоль/л, то досліджують кров після цукрового навантаження (дають випити 75 г глюкози, розчиненої у воді). Концентрація через 2 год після навантаження 10 ммоль/л і вище вказує на цукровий діабет, а концентрація від 8 до 10 ммоль/л – на знижену толерантність до глюкози. У частини осіб із порушеною толерантністю до глюкози можливий розвиток діабету.
http://www.youtube.com/watch?NR=1&v=iz8dlE4PjIQ
У хворих на цукровий діабет глюкоза може виділятись із сечею, зокрема після споживання їжі, при тяжких формах хвороби і під час голодування. Саме глюкозурія послужила основою для назви захворювання. У сечі здорових людей концентрація глюкози дуже низька, менша 0,8 ммоль/л (150 мг/л), оскільки клітини проксимальних відділів ниркових канальців майже повністю реабсорбують глюкозу з первинної сечі. Такий низький рівень глюкози в сечі виявляється лише високочутливими методами. Коли концентрація глюкози в плазмі крові й клубочковому фільтраті перевищує 10 ммоль/л, реабсорбційна здатність ниркових канальців стає недостатньою і певна кількість глюкози виділяється із сечею. Гіперглікемічна глюкозурія спостерігається не тільки при цукровому діабеті, а й при всіх захворюваннях, які супроводжуються рівнем гіперглікемії, вищим за нирковий поріг. Але в ряді випадків глюкозурія не розвивається, хоч вміст глюкози в плазмі крові перевищує нирковий поріг. Це спостерігається тоді, коли об'єм клубочкового фільтрату малий, загальна кількість глюкози, що надходить у ниркові канальці, низька і повністю реабсорбується.
Глюкозурія може бути і за нормальної чи дещо підвищеної концентрації глюкози в плазмі крові, якщо виникає дефект мембранотранспортного механізму в канальцях (ниркова глюкозурія). У даному випадку нирковий поріг знижений. Ниркова глюкозурія спостерігається іноді при вагітності, спадковій недостатності проксимальних відділів ниркових канальців, дії на клітини проксимальних канальців токсичних речовин (важких металів, органічних розчинників тощо)
Гіпоглікемія виникає при таких патологічних станах:
1) надмірно високому вмісті інсуліну внаслідок пухлин чи гіперплазії клітин острівців підшлункової залози;
2) гіпофункції надниркових залоз;
3) гіпофункції гіпофіза;
4) багатьох типах злоякісних пухлин, локалізованих поза підшлунковою залозою;
5) тяжких ураженнях печінки, нервової системи, шлунка і кишечника;
6) у ранньому дитячому віці при спадкових порушеннях обміну вуглеводів – галактоземії, непереносимості фруктози, деяких типах глікогенозів.
Крім того, гіпоглікемію можуть спричиняти деякі ліки, споживання значної кількості алкоголю. Найпоширенішими в клінічній практиці є гіпоглікемії, викликані надмірним введенням інсуліну хворим на цукровий діабет, а також прийомом ряду інших лікарських середників. Гіпоглікемію, зумовлену надмірним введенням інсуліну чи високою продукцією ендогенного інсуліну, діагностують шляхом визначення вмісту інсуліну. Симптоми гіпоглікемії розвиваються, коли концентрація глюкози в плазмі крові стає нижчою 2,5 ммоль/л (45 мг/дл). Спостерігаються запаморочення, корчі та інші неврологічні порушення аж до гіпоглікемічної коми. Прояви посилюються при значному фізичному навантаженні чи при тривалих перервах між споживанням їжі.
Поширення і значення
Гранули глікогену у м'язовій клітині
Глікоген є формою запасання глюкози у тварин[3][4], грибів[7], деяких бактерій (зокрема ціанобактерій[8]) та арехей[9]. У мікроорганізмів глікоген більш менш рівномірно розкиданий по цитоплазмі клітини у вигляді гранул діаметром 20—100 нм, їх зазвичай можна побачити тільки через електронний мікроскоп. Якщо клітина містить багато глікогену вона стає червоно-коричневою при зафарбовуванні розчином йоду[10]. У хребетних тварин найбільші кількості глікогену запасаються печінкою, де він може становити 7—10 % загальної маси[11] (100 —120 г у дорослої людини), та скелетними м'язами (1-2 % від загальної маси)[11]. Невеликі кількості глікогену знаходяться в нирках, і ще менші — в певних гліальних клітинах мозку і білих кров'яних тільцях.
Запасання глюкози не у вільній формі, а саме у вигляді полісахаридів диктується двома причинами. По-перше, якби, наприклад, у гепатоциті вся маса глюкози, що входить до складу глікогену, перебувала у вільному стані, її концентрація сягнула би 0,4nbsp;моль/л. А це у свою чергу призвело би до значного підвищення осмотичного тиску цитозолю, надмірного надходження води у клітину і її розривання[12]. По-друге, така висока концентрація глюкози зробила би фактично неможливим її активний транспорт із оточення клітини, у випадку гепатоцита із крові, де рівень глюкози становить всього 5 ммоль/л[3]. Зберігання ж глюкози у формі глікогену дозволяє скоротити її концентрацію у клітині до 0,01 мкмоль/л[12].
Запаси глікогену у людей значно менші ніж запаси жирів. Останні мають ряд переваг: по-перше, вони дають можливість отримати більше ніж вдвічі більше енергії ніж така ж маса вуглеводів, по-друге це гідрофобні молекули і, на відміну від вуглеводів, не потребують гідратації, а це дозволяє скоротити масу енергетичних запасів. Проте глікоген є швидшим джерелом енергії, крім того в організмі тварин відсутні метаболічні шляхи перетворення жирних кислот у глюкозу, а отже вони не можуть використовуватись мозком і в анаеробному метаболізмі м'язів[12].
У гепатоцитах глікоген зберігається у вигляді великих цитоплазматичних гранул. Елементарна так звана β-частинка, що є однією молекулою гілкогену, має діаметр близько 21 нм і включає до 55 000 залишків глюкози та має 2000 нередукуючих кінців. 20-40 таких часточок разом утворюють α-розетки, які можна бачити у під мікроскопом у тканинах тварин, яких добре годують. Проте вони зникають після 24-годинного голодування. Глікогенові гранули — це складні агрегати, до складу яких крім самого глікогену входять ферменти, що синтезують і розщеплюють його, а також регуляторні молекули[12].
Глікоген у м'язах слугує джерелом швидкої енергії як за аеробного, так і за анаеробного метаболізму. Його запаси можуть бути вичерпані за одну годину інтенсивного фізичного навантаження. Регулярне тренування дозволяє збільшити запаси глікогену в м'язах, внаслідок чого вони можуть довше працювати без втоми[13]. У печінці глікоген є резервом глюкози для інших органів, на той випадок, якщо її надходження із їжею обмежене. Особливо важливий такий запас для нейронів, які не можуть використовувати в якості енергетичного субстрату жирні кислоти. Печінковий запас глікогену під час голодування вичерпується за 12-24 годин[12].
Глікоген також міститься у секреті залоз матки, який вони виділяють в її порожнину у постовуляційний період менструального циклу після запліднення. Тут полісахарид використовуються як джерело живлення для ембріона до його імплатнтації[13].
Глікоген також надходить в організм із їжею і розщеплюється у тонкому кишківнику гідролітичними ферментами[12].
[ред.]
Метаболізм глікогену
[ред.]
Розщеплення глікогену
Розщеплення глікогену відбувається двома основними шляхами: під час травлення він гідролізується до глюкози, яка може всмоктуватись клітинами епітелію тонкого кишківника. Внутрішньоклітинне розщеплення запасів глікогену (глікогеноліз) йде шляхом фосфоролізу, продуктом якого є глюкозо-1-фосфат, цей шлях дозволяє зберегти частину енергії глікозидних зв'язків шляхом формування фосфатного естеру[14]. Таким чином для включення утвореної глюкози у гліколіз або пентозофосфатний шлях не потрібно затрачати АТФ. Крім того утворення глюкозо-1-фосфату є вигідним для м'язів, оскільки для цієї сполуки нема переносників у плазмалемі, і вона не може «втікати» із клітини[15].
[ред.]
Гідроліз глікогену під час травлення
У людини перетравлення глікогену (як і крохмалю) починається у ротовій порожнині, де на нього діє α-амілаза слини. Цей фермент гідролізує внутрішньомолекулярні (α1→4)-зв'язки і розщеплює полісахариди до олігосахаридів. У шлунку амілаза слини інактивується через високу кислотність середовища. Шлунковий сік не містить ферментів для перетравлення вуглеводів. У дванадцятипалій кишці на (α1→4)-зв'язки глікогену діє панкреатична α-амілаза, а на (α1→6)-зв'язки — спеціальний дерозгалужуючий фермент аміло-1,6-глікозидаза. Так завершується гідроліз глікогену до мальтози, яка під впливом пристінкового ферменту тонкого кишківника мальтази (α-глюкозидази) перетворюється у глюкозу і всмоктується[16].
[ред.]
Глікогеноліз
Схема реакцій глікогенолізу
Докладніше: Глікогеноліз
Внутрішньоклітинний глікоген м'язів та печінки розщеплюється у процесі глікогенолізу, в якому беруть участь три ферменти: глікогенфосфорилаза, глікогендерозгалужуючий фермент та фосфоглюкомутаза. Перший із них каталізує реакцію, в якій неорганічний фосфат атакує глікозидний (α1→4)-зв'язок між двома останніми залишками глюкози із нередукуючого кінця, внаслідок чого відбувається відщеплення останнього залишку у вигляді глюкозо-1-фосфату. Кофактором у цій реакції виступає пірідоксальфосфат[14].
Глікогенфосфорилаза послідовно відщеплює по одному мономеру від нередукуючого кінця поки не досягає місця віддаленого на чотири залишки від (α1→6)-зв'язку (точки галуження). Тут вступає в дію біфункціональний (в еукріот[17]) дерозгалужуючий фермент. Спочатку він каталізує трансферазну реакцію, що полягає у перенесенні блоку із трьох глюкозних залишків із гілки на найближчий нередукуючий кінець, до якого він прикріплюється (α1→4)-зв'язком. Після цього дерозгалужуючий фермент проявляє (α1→6)-глюкозидазну активність, яка полягає у розщепленні (α1→6)-зв'язку і виділенні вільної глюкози[14][15].
Утворений глюкозо-1-фосфат перетворюється фосфоглюкомутазою до глюкозо-6-фосфату, який у скелетних м'язах вступає у процес гліколізу. У печінці глюкозо-6-фосфат також може транспортуватись в ендоплазматичний ретикулум, там підлягати дії глюкозо-6-фосфатази (м'язи позбавлені цього ферменту), перетворюватись у глюкозу і виділятись у кров[14][18].
[ред.]
Біосинтез глікогену
Докладніше: Глікогенез
У незначній мірі біосинтез глікогену (глікогенез) відбувається майже у всіх тканинах організму, проте найбільше він виражений у печінці та м'язах. Цей процес розпочинається із глюкозо-6-фосфату, що утворюється із глюкози в гексокіназній або глюкокіназній реакції. Частина глюкози, що поступає в організм із їжею, спочатку поглинається еритроцитами, які використовують її для отримання енергії у процесі молочнокислого бродіння. Утворений лактат у гепатоцитах перетворюється до глюкозо-6-фосфату в процесі глюконеогенезу[19].
Метаболічні шляхи біосинтезу та розпаду певних сполук зазвичай відрізняються принаймні деякими із реакцій. Метаболізм глікогену був першим відкритим прикладом цього важливого принципу. 1957 року Луїс Лелуар встановив, що в процесі глікогенезу використовується не глюкозо-1-фосфат, а уридиндифосфатглюкоза[20].
Глюкозо-6-фосфат спершу перетворюється до глюкозо-1-фосфат під впливом фосфоглюкомутази. Продукт цієї реакції стає субстратом для ферменту УДФ-глюкозофосфорилази, яка каталізує реакцію:
Глюкозо-1-фосфат + УТФ → УДФ-глюкоза + ФФн.
Оскільки пірофосфат відразу розщеплюється неорганічною пірофосфатазою, то рівновага реакції сильно зміщена в сторону утворення УДФ-глюкози. Остання є субстратом для глікогенсинтази, що переносить залишок глюкози на нередукуючий кінець молекули глікогену[21].
Утворення бічних гілок забезпечує гілкозил-(4→6)-трансглікозилаза (розгалужуючий фермент). Вона відщеплює від гілки, що містить більше 11 мономерних одиниць 6—7 останніх і переносить їх на C6 гідроксильну групу залишку глюкози у більш внутрішньому положенні на тій самій або іншій гілці. Таким чином відбувається галуження, необхідне для кращої розчинності глікогену, та доступу більшої кількості ферментів синтезу та розщеплення до нередукуючих кінців[22].
Глікогенсинтаза може синтезувати глікоген тільки за умови наявності праймера — готового полімеру глюкози із принаймні шістьма мономерними одиницями. Утворення молекул глікогену de novo можливе тільки завдяки білку глікогеніну, що виступає одночасно і «затравкою», на якій збираються нові гілки глікогену і ферментом, що каталізує початок утворення перших із них[22].
Глікогенез та гілкогеноліз мають складну систему регулювання на кількох рівнях. Багато із ферментів, що беруть участь у цих процесах є алостеричними і можуть змінювати свою активність пристосовуючись до потреб клітини. Кількість запасів глікогену також регулюється на гормональному рівні для підтримання гомеостазу цілого організму[23].
[ред.]
Клінічне значення
Порушення обміну глікогену спостерігається при багатьох захворюваннях людини, зокрема при цукровому діабеті. Існує також ряд спадкових розладів, пов'язаних із надмірним відкладанням глікогену в печінці, вони називаються глікогенозами. Вони зазвичай супроводжуються вираженою гіпоглікемією (зниженим вмістом глюкози в крові) між прийомами їжі.
Дата добавления: 2015-09-05; просмотров: 485 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глюконеогенез | | | От издательства |