
Читайте также:
|
По молекулярно-кинетической теории, скорости молекул при хаотическом движении изменяются как по модулю, так и по направлению. Однако средняя квадратичная скорость при постоянной температуре остается постоянной, поэтому < Е 0 > можно записать как

Постоянство  объясняется тем, что в газе устанавливается стационарное, не меняющееся со временем распределение молекул по скоростям. Максвелл вывел функцию распределения молекул по скоростям, имеющую вид:
объясняется тем, что в газе устанавливается стационарное, не меняющееся со временем распределение молекул по скоростям. Максвелл вывел функцию распределения молекул по скоростям, имеющую вид:

Вид функции зависит от температуры и массы молекул.


| рис.19 | рис.20 |
Функция  при
при  и достигает
и достигает  при некотором значении vв, а затем стремится к нулю (рис.20). Если разбить диапазон скоростей на малые интервалы d v, то относительное число молекул, скорости которых лежат в интервале от v до
при некотором значении vв, а затем стремится к нулю (рис.20). Если разбить диапазон скоростей на малые интервалы d v, то относительное число молекул, скорости которых лежат в интервале от v до  равно
равно 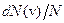
 откуда
откуда 
и находится как площадь показанной на рис.19 заштрихованной полоски основанием d v и высотой f (v). Вся площадь, ограниченная кривой, равна 1.
С ростом температуры кривая распределения смещается вправо, т.е. растет число быстрых молекул.
Скорость 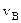 , которой обладает максимальное число молекул при данной температуре – наиболее вероятная скорость (функция f (v) достигает максимального значения). Средняя арифметическая скорость рассчитывается как:
, которой обладает максимальное число молекул при данной температуре – наиболее вероятная скорость (функция f (v) достигает максимального значения). Средняя арифметическая скорость рассчитывается как:

Опыт Штерна экспериментально подтвердил справедливость распределения Максвелла.
Дата добавления: 2015-09-05; просмотров: 54 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Основное уравнение молекулярно-кинетической теории идеальных газов | | | И средняя длина свободного пробега молекул |