
Кондуктометрический метод анализа основан на измерении электрической проводимости (электропроводности) растворов электролитов.
Растворы электролитов обладают способностью проводить электрический ток под действием электрического поля. Двигающиеся в растворе ионы в поле электрического тока испытывают тормозящее действие со стороны молекул растворителя и окружающих противоположно заряженных ионов. Это так называемый релаксационный и электрофоретический эффекты. Результатом такого тормозящего действия является сопротивление раствора прохождению электрического тока. Электропроводность раствора W обратна его электрическому сопротивлению R:
W = 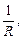 (1)
(1)
где W – электропроводность раствора, Ом-1 или См (сименс),
R – электрическое сопротивление раствора, Ом
Для измерения электропроводности растворов используются электроды, погруженные в этот раствор. Сопротивление раствора обратно пропорционально площади электродов S (см2) и прямо пропорционально расстоянию между ними 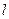 (см):
(см):
R =  (2)
(2)
где  - коэффициент пропорциональности, называемый удельным сопротивлением, Ом . см;
- коэффициент пропорциональности, называемый удельным сопротивлением, Ом . см;
Если принять 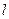 = 1 см, S = 1 см2, то R =
= 1 см, S = 1 см2, то R =  . При этих условиях удельное сопротивление равно сопротивлению 1 см3 раствора.
. При этих условиях удельное сопротивление равно сопротивлению 1 см3 раствора.
В аналитических целях величина “электропроводность – W” как таковая используется крайне редко, поскольку электропроводность любого проводника – раствора или металла – зависит от его размеров и форм. Чтобы не учитывать зависимость электропроводности от размеров проводника, пользуются понятием “удельная электропроводность  ”. Удельная электропроводность
”. Удельная электропроводность  (Ом-1 . см-1 или См . см-1) является величиной, обратной удельному сопротивлению:
(Ом-1 . см-1 или См . см-1) является величиной, обратной удельному сопротивлению:
 =
=  (3)
(3)
Удельная электропроводность  характеризует только проводящую среду, т.к. она не зависит от геометрии проводника.
характеризует только проводящую среду, т.к. она не зависит от геометрии проводника.
Удельная электропроводность соответствует электропроводности раствора объемом в 1 см3, находящегося между электродами площадью 1 см2, расположенным на расстоянии 1 см друг от друга.х)
Для разбавленных растворов удельная электропроводность изменяется пропорционально концентрации. Поэтому в расчетах удобно пользоваться эквивалентной электропроводностью.
Эквивалентной электропроводностью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Единицей измерения 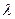 является См.см2/моль экв. (СИ).
является См.см2/моль экв. (СИ).
Удельная и эквивалентная проводимость взаимно связаны соотношением:
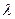 =
=  , (4)
, (4)
где С – молярная концентрация эквивалента, моль/л.
Подвижность ионов имеет постоянное максимальное значение при бесконечном разбавлении раствора, поэтому эквивалентная электропроводность раствора электролита при бесконечном разбавлении представляет собой постоянную величину, равную сумме подвижностей ионов при бесконечном разбавлении:
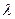 0 =
0 = 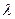 0+ +
0+ + 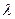 0- (5)
0- (5)
где 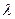 0+ ,
0+ , 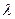 0- - предельная электропроводность (подвижность) ионов.
0- - предельная электропроводность (подвижность) ионов.
Если ион несет более одного заряда, то значение подвижности иона относят к одному заряду.
Когда в растворе присутствует больше, чем два вида ионов или смеси любых электролитов, эквивалентная электропроводность определяется уравнением Кольрауша:
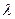 =
=  (6) Закон аддитивности электричес-
(6) Закон аддитивности электричес-
кой проводимости растворов
электролитов при бесконечном
разведении
где: С – общая концентрация электролита,
Сi –концентрация, I – ого вида ионов,
Zi - заряд ионов,
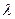 - ионные электрические проводимости (их величины указаны в книге Дж.Плэмбека “Электрохимические методы анализа”, М., “Мир”, 1985)
- ионные электрические проводимости (их величины указаны в книге Дж.Плэмбека “Электрохимические методы анализа”, М., “Мир”, 1985)
 |
х) Примечание Формулы, обозначения и размерности некоторых величин в системах СИ и СГС сведены в таблицу 3
Таблица 3
| № пп | Наименование величин | Обоз- наче- ние | Наименование размерности | Расчетные формулы | |
| Система СГС | Система СИ | ||||
| Электрическое сопротивление | R | Ом | Ом | 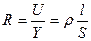
 ; U=Y · R ; U=Y · R

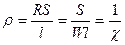

| |
| Сила тока | J | А (Ампер) | А (Ампер) | ||
| Электрическое напряжение | U | В (Вольт) | В (Вольт) | ||
| Электрическая проводимость (электро-проводность) | W | Ом-1 | См (сименс) | ||
| Длина проводника | 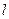
| см | м | ||
| Площадь сечения проводника | S | см2 | м2 | ||
| Удельное электрическое сопротивление | 
| Ом . см | Ом . м | ||
| Удельная электрическая проводимость | 
| Ом-1 . см-1 | Ом-1 . м-1 или Ом-1 . см-1 | ||
| Эквивалентная электрическая проводимость (эквивалентная электро-проводность) | λ | см2/Ом.(г-экв) | Ом.см2/моль экв. Ом.м2.моль-1 | ||
| Концентрация раствора | C | г- экв . л-1 | моль . см-3 | ||
| Объем раствора | V | л=дм3 мл=см3 | м3 |
Аномально высокая подвижность ионов водорода и гидроксида в водных растворах объясняется особым механизмом передвижения этих ионов.
Известно несколько методов кондуктометрического анализа. Методом прямой кондуктометрии концентрация вещества определяется по электрической проводимости раствора, если между ними существует прямая пропорциональность и, в основном, для анализа однокомпонентных систем. Прямую кондуктометрию используют сравнительно редко, поскольку регистрируемый аналитический сигнал избирателен: электропроводность-величина аддитивная, определяемая наличием всех ионов в растворе.
Прямые кондуктометрические измерения успешно используют, например, для оценки чистоты растворителя, речных и минеральных вод, а также для определения констант диссоциации электролитов, состава и константы устойчивости комплексных соединений, растворимости малорастворимых электролитов.
Большое распространение в аналитической практике получил метод кондуктометрического титрования, основанный на использовании химической реакции, в результате которой происходит заметное изменение электропроводности раствора. При кондуктометрическом титровании могут быть использованы химические реакции всех типов.
Кондуктометрическое титрование обладает рядом достоинств: возможно дифференцированное титрование смесей ряда кислот или оснований, титрование мутных, окрашенных растворов, а также возможно титрование при образовании гидролизующихся солей. Нижний предел определяемых концентраций 10-4 моль/л, погрешность определений 2%.
При кондуктометрическом титровании происходит замещение ионов, находящихся в анализируемом растворе и участвующих в реакции с титрантом, ионами титранта, подвижностью которых больше или меньше подвижности ионов анализируемого раствора. Этим обусловлено получение восходящих или нисходящих ветвей кривых кондуктометрического титрования. Точность установления точки эквивалентности определяются углом пересечения прямых: угол должен быть как можно меньше, так как только в этом случае наблюдается излом на кривой титрования. Наиболее острый угол пересечения прямых получается при кислотно-основном титровании, так как ионы Н+ и ОН- вносят особенно большой вклад в электропроводность раствора. Наряду с реакциями кислотно-основного взаимодействия в кондуктометрии можно применять реакции осаждения, комплексообразования, окисления-восстановления.
В кислотно-основном титровании возможны следующие случаи (см. рис.9, 10, 11).
 х Ом-1.см-1
х Ом-1.см-1
 d
d
 а
а

 в с
в с

сильная слабая
кислота кислота
 |
О V
см3 , титранта
Рис.9. Кривая титрования смеси сильной и слабой кислот сильным основанием.

 Х
Х
 тэ
тэ


 тэ
тэ
 |  |
V, см3 V, см3
а б
Рис.10. Кривые титрования слабой кислоты
а) сильным основанием, б.) слабым основанием
При осадительном титровании катион или анион анализируемого раствора образует осадок с анионом (или соответственно катионом) титранта.
Кондуктометрическое титрование обладает рядом преимуществ. Его можно проводить в мутных и окрашенных средах, а также в присутствии окислителей и восстановителей, ограничивающих применение кислотно-основных индикаторов. Метод обладает повышенной чувствительностью и позволяет анализировать разбавленные растворы (до 10-4); более точно устанавливается конечная точка при титровании слабых кислот и оснований.
Дата добавления: 2015-08-20; просмотров: 129 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Определение нитратов в экстрактах пищевого сырья | | | Выполнение работы. |