
Читайте также:
|
Окружающий нас мир состоит из трёх структурных частиц: атом, молекула, ион. Например, медная пластина состоит из атомов (Сu). В водном растворе сульфата меди (СuSO4) медь присутствует в виде ионов (Сu2+). Атомы (Сu), ионы (Сu2+) являются структурными частицами химического элемента медь. Газ водород состоит из молекул (Н2). Раствор хлороводородной кислоты (НСl) содержит ионы (H+). Молекулы (Н2), ионы (H+) являются структурными частицами химического элемента водород.
Химический элемент – это вид структурных частиц с одинаковым зарядом ядра.
Атом – это наименьшая частица элемента, имеющая его химические свойства.
Согласно современной теории строения атома, атом состоит из ядра /протоны, нейтроны/ и электронной оболочки /электроны/.
Протон (р): относительный заряд равен +1; относительная масса 1,0073.
Нейтрон(n): относительный заряд равен 0; относительная масса 1,0087.
Электрон(е): относительный заряд равен –1; относительная масса 5,48 · 10-4
Периодическая система элементов Д.И.Менделеева позволяет определить число фундаментальных частиц (р,n,е) в атоме любого элемента. Английский физик Мозли установил, что «заряд ядра равен порядковому номеру элемента в Периодической системе». Так как заряд протона равен единице, то порядковый номер определяет число протонов. Атом по заряду - нейтральная частица, следовательно, число электронов в атоме равно числу протонов. Относительная атомная масса элемента определяется сумой масс протонов и нейтронов. Поэтому, число нейтронов в атоме равно атомной массе за вычетом числа протонов.
Пример 1. Определить число протонов, нейтронов, электронов в атоме элемента с порядковым номером 92 в Периодической системе элементов Д.И. Менделеева
Элемент Уран 
Число протонов (р) равно 92
Число нейтронов (n) равно 238 – 92 = 146
Число электронов (е) равно 92
Изотопы - это структурные частицы, имеющие одинаковое число протонов, но разное число нейтронов (частицы одного и того же элемента с различной массой).
Например  -водород,
-водород, 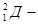 дейтерий,
дейтерий,  -тритий
-тритий
При рассмотрении строения электронной оболочки атома учитывается, что из-за корпускулярно-волновой природы электрона существует неопределённость в установлении его места пребывания. Шредингер предложил волновое уравнение для атома. Решение этого уравнения даёт плотность вероятности нахождения электрона в данной области пространства. Область пространства вокруг ядра, для которой вероятность пребывания электрона равна 95%, называется атомной орбиталью. Электрон не движется по орбите, а занимает трёхмерную область в пространстве вокруг ядра – орбиталь. Решения волнового уравнения Шредингера позволяют охарактеризовать орбиталь четырьмя квантовыми числами.
n – главное квантовое число. Может принимать значения 1,2,3,4,5,6,7…∞. Определяет энергетический уровень, на котором находится электрон, энергию электрона на уровне, размер орбитали. Чем больше значение главного квантового числа, тем больше энергия электрона и больше размер орбитали.
l-орбитальное квантовое число. Может принимать целочисленные значения от 0 до n-1. Если n = 4, то l = 0,1,2 и 3. Определяет энергетический подуровень, на котором находится электрон, энергию электрона на подуровне, а так же форму орбитали. Каждое значение l обозначают буквой (чтобы не путать с обозначением n): l = 0 (s), 1 (p), 2 (d), 3 (f) и т.д.
Состояние электрона, характеризуемое значениями l и n, записывается в виде электронной формулы.
Например, еслисостояние электрона характеризуется n = 4, l = 3, то говорят, что это - 4f-электрон.
Возможные следующие сочетания этих двух квантовых чисел:
n = 1 l = 0 1s
n = 2 l = 0,1 2s2p
n = 3 l = 0,1,2 3s3p3d
n = 4 l = 0,1,2,3 4s4p4d4f
и т.д.
В пределах одного энергетического уровня наименьшей энергией обладают электроны на s-подуровне (s-электроны), а затем s<p<d<f< и т.д.
Электроны на s-подуровне (s-электроны) имеют сферическую форму орбитали, p-электроны симметричную гантель, у других орбиталь имеет более сложную конфигурацию.

Рис. 1. Форма электронных облаков s и p - орбиталей
m-магнитное квантовое число. Может принимать значение целых чисел от +l до –l. Определяет возможное число орбиталей на подуровне, а так же пространственное расположение орбиталей.
Возможное число орбиталей для подуровней:
l = 0 (s) m = 0 одна s-орбиталь
l = 1 (p) m = 1,0,-1 три p-орбитали
l = 2 (d) m = 2,1,0,-1,-2 пять d-орбиталей и т. д.

Рис. 2. Пространственное расположение р-орбиталей
S-спиновое квантовое число. Определяет вращение электрона вокруг собственной оси. Может принимать значения +1/2 (предполагает вращение по часовой стрелке) и –1/2 (вращение против часовой стрелки). Во многоэлектронных атомах электроны располагаются по энергетическим уровням (n), подуровням (l) и орбиталям (m). Если орбиталь изобразить в виде ячейки □, то структура электронной оболочки будет иметь вид:
 1
1
s



 2
2
s p








 3
3
s p d
4 














 и т.д.
и т.д.
s p d f
В соответствии с принципом Паули «в атоме не может быть двух электронов, которые имеют одинаковые наборы четырёх квантовых чисел». Таким образом, на одной орбитали могут находиться только два электрона с противоположными спинами.
Отсюда следует, что:
на n=1 уровне находится 2 электрона 1s2
на n=2 уровне находится 8 электронов 2s22р6
на n=3 уровне находится 18 электронов 3s23р63d10
на n=4 уровне находится 32 электрона 4s24р64d104f14 и т.д.
Заполнение электронной оболочки атома электронами происходит по принципу наименьшей энергии (правило Клечковского):
1. В первую очередь заполняется энергетическое состояние с наименьшей суммой главного и орбитального квантовых чисел(n+l). Последующее заполнение происходит в порядке увеличения суммы n+l.
2. При равных значениях суммы n + l заполняется энергетический уровень с меньшим значением главного квантового числа.
Пример 2. Определить порядок заполнения электронами уровней и подуровней 5d, 6p, 6s.
5d = 5 + 2 = 7; 6p = 6 + 1 = 7; 6s = 6 + 0 = 6.
Порядок заполнения 6s,5d,6р.

 Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда «каждая орбиталь заполняется вначале одним электроном, а затем происходит их заполнение вторыми электронами».
Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда «каждая орбиталь заполняется вначале одним электроном, а затем происходит их заполнение вторыми электронами».
 Например, р4:
Например, р4:
Электронные оболочки записываются в виде электронных формул.
Напимер,  1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p2
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p2
Если сопоставить строение электронной оболочки атома и Периодическую систему элементов Д.И. Менделеева, то видно, что Периодическая система элементов Д.И. Менделеева представляет собой классификацию элементов по структуре заполненных электронных оболочек атомов.
Период – последовательный ряд элементов с одинаковым числом заполняемых энергетических уровней, причём номер периода показывает номер внешнего энергетического уровня.
Группа – последовательный ряд элементов, имеющих однотипную электронную конфигурацию.
Например, элемент  находится в 3 периоде, электронная формула: 1s22s22p63s23p2
находится в 3 периоде, электронная формула: 1s22s22p63s23p2
Элемент 52Sn находится в 5 периоде, электронная формула: 1s22s22p63s23p64s23d104p65s24d105p2
В зависимости от подуровня, который заполняет последний электрон, все элементы можно сгруппировать в четыре электронных семейства.
s – элементы – достраивается s - подуровень
p – элементы – достраивается p - подуровень
d – элементы – достраивается d - подуровень
f – элементы – достраивается f – подуровень
В Периодической системе элементов Д.И. Менделеева s- и р - элементы расположены в главных подгруппах, у этих элементов достраивается внешний энергетический уровень (соответствует номеру периода). d- и f-элементы расположены в побочных подгруппах, у этих элементов достраиваются предвнешние уровни.
Учитывая периодичность заполнения электронами энергетических уровней и взаимосвязь заряда ядра и количества электронов в атоме, Периодический закон Д.И Менделеева может быть сформулирован следующим образом: «свойства простых тел, а также соединений элементов находятся в периодической зависимости от заряда ядра атома».
Начинается период (со II периода) элементом, в атоме которого появился на внешнем уровне s-электрон (активный металл). Заканчивается период элементом в атоме, которого на внешнем уровне s2p6 – электроны (благородный газ). Все элементы в соответствии с электронным строением атома можно подразделить на металлические и неметаллические. Металлические свойства элементов определяются способностью атомов «отдавать» электроны (восстановительные свойства). Неметаллические свойства элементов определяются способностью атомов «принимать» электроны (окислительные свойства). Изменение свойств элементов в Периодической системе можно проследить в горизонтальном направлении (в периоде) и вертикальном направлении (в группе). С увеличением порядкового номера элементов по периоду (слева на право) происходит нарастание неметаллических свойств. Сверху вниз по подгруппам возрастают металлические свойства. Эти свойства связаны с атомными радиусами, а в конечном счете - с электроотрицательностью. Элементы, для которых электроотрицательность меньше двух относят к металлическим элементам (атомы только отдают электроны). Элементы, для которых электроотрицательность больше двух, относят к неметаллическим элементам. Чем ниже электроотрицательность, тем выше металлические свойства элемента и наоборот, чем выше электроотрицательность, тем выше неметаллические свойства.
Дата добавления: 2015-08-18; просмотров: 82 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| КОНТРОЛЬНЫЕ ЗАДАНИЯ | | | Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. |