
Читайте также:
|
1. Неполная нейтрализация многоосновных кислот
2NaOH + H3PO4 = Na2HPO4 + 2H2O
NaOH + H3PO4 = NaH2PO4 + H2O
2. Взаимодействие средних солей с оксидами
CaСO3↓ + CaO +H2O = Ca(НCO 3)2
5. Комплексные соединения
Теория комплексных соединений была предложена в 1893 году Альфредом Вернером. Согласно этой теории, основу комплексного соединения составляет центральный атом, называемый комплексообразователь или металлоцентр. Рис. 3.

Рис. 3.
В качестве такового выступают частицы, имеющие вакантные орбитали, часто имеющие значительный положительный заряд. В качестве комплексообразователя выступают катионы переходных металлов. Вокруг центрального атома размещаются лиганды. Лиганды – это ионы или молекулы, непосредственно связанные с комплексообразователем, являющиеся донорами электронных пар. Это могут быть однозарядные частицы (Сl-, CNS-, CN-), а также нейтральные молекулы, в атомах которых есть неподелённые пары электронов (H2O, NH3, CO). Координационное число может быть 4 или 6. При образовании комплекса между центральными атомами и лигандами образуется ковалентная связь по обменному или донорно-акцепторному механизму. Из-за этого и комплексообразователь, и лиганды меняют свои свойства при образовании комплекса. Так, например, лиганды не всегда можно обнаружить типичной для них при обнаружении реакцией. В комплексных соединениях выделяют внутреннюю и внешнюю сферу. Внутренняя сфера заключается в квадратные скобки. Если внутренняя сфера заряжена, то для неё должен быть противоион, который находится во внешней сфере. Рассмотрим это на примере гидроксоалюмината калия.
K+ [Al3+ (OH)-4]-
К комплексным соединениям относится реактив Толленса (гидроксид диамминсеребра (1)) — щелочной раствор аммиаката серебра [Ag(NH3)2]ОН.), который используется при реакции серебряного зеркала. Комплексными являются гидроксиды некоторых металлов. При галогенировании ароматических соединений могут образовываться комплексные галогениды. Например, тетрахлороалюминат калия. При взаимодействии гидроксида меди с гликолем образуются органические комплексы меди, и это является качественной реакцией на гликоли. К комплексным соединениям относится хлорофилл и гемоглобин.
6. Принцип жестких и мягких кислот и оснований
Эта теория является развитием теории кислот и оснований Льюиса (рис. 4).
Нам необходимо вспомнить, что такое поляризуемость.

Рис. 4.
Поляризуемость – это способность электронной оболочки изменяться под действием внешнего электронного поля.
В данной теории (ЖМКО) кислоты и основания делятся на жёсткие и мягкие. Рис. 5.
Рис. 5.
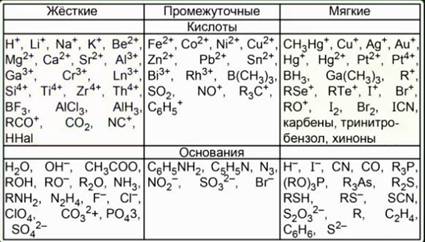
Жесткими кислотами являются акцепторы с высокой электроотрицательностью и низкой поляризуемостью. В мягких кислотах – низкая электроотрицательность и высокая поляризуемость. Жесткие основания – это доноры с высокой электроотрицательностью и низкой поляризуемостью. Мягкие основания – с низкой электроотрицательностью и высокой поляризуемостью. Самая жесткая кислота – это протон Н+. Самая мягкая – это СН3Нg+. Наиболее жесткие основания – это F- и ОН- . Главная идея этой теории – это то, что подобное взаимодействует с подобным. Жёсткие кислоты больше хотят взаимодействовать с жесткими основаниями.
Например, бромид серебра растворим меньше, чем хлорид, а иодид растворим меньше, чем бромид. Образование иодида серебра наименее выгодно, значит, он наименее растворим. Эта теория очень полезна при объяснении или предсказании механизма реакций.
Дата добавления: 2015-08-17; просмотров: 89 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства кислых солей | | | ПАРНЫЙ РЕГРЕССИОННЫЙ АНАЛИЗ |