
Читайте также:
|
Из химической термодинамики вы знаете, что самопроизвольно протекают только те процессы, которые приводят к уменьшению свободной энергии системы. Если процессы проводятся в условиях постоянства объема и температуры, они должны приводить к уменьшению свободной энергии Гельмгольца (dF<0). Процессы, протекающие при постоянных давлении и температуре, должны сопровождаться уменьшением свободной энергии Гиббса (dG<0). Если процессы в поверхностном слое не сопровождаются химическими реакциями, состав системы остается постоянным ( = const). Рассмотрим, какие процессы в поверхностном слое отвечают указанным условиям.
= const). Рассмотрим, какие процессы в поверхностном слое отвечают указанным условиям.
Выше отмечалось, что поверхностное натяжение – это свободная поверхностная энергия, приходящаяся на единицу площади межфазной поверхности. Значит, если процесс протекает при V, Т,  = const, то
= const, то

Соответственно для изобарно-изотермических процессов
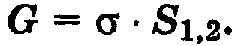
Дифференцируя (2.4) и (2.5), получим:

Условием самопроизвольного протекания как изохорно-изотермических, так и изобарно-изотермических процессов является
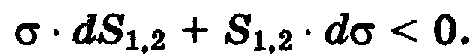
Для индивидуальных веществ поверхностное натяжение постоянно (σ=const, dσ=0).
В этих случаях самопроизвольно могут протекать процессы, сопровождающиеся уменьшением межфазной поверхности (dS1-2<0). К поверхностным явлениям, связанным с уменьшением поверхности, можно отнести:
• стремление капель жидкости или пузырьков газа принять сферическую форму (сферические частицы имеют самую маленькую удельную поверхность);
• слипание твердых частиц дисперсной фазы (коагуляция);
• слипание капель в эмульсиях или пузырьков газа в пенах (коалесценция);
• рост кристаллов.
Если площадь межфазной поверхности остается постоянной (Si, 2 = const, dS1-2=0), условие (2.8) может выполняться за счет уменьшения поверхностного натяжения (dσ<0), которое может быть обусловлено процессом адсорбции.
5. Адсорбция: общие положения, классификация
Адсорбцией называется самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с его концентрацией в объеме фазы.
Более плотную фазу (определяющую форму поверхности) принято называть адсорбентом, вещество, молекулы которого могут адсорбироваться – адсорбтивом, уже адсорбированное вещество – адсорбатом.
Процесс, обратный адсорбции, называют десорбцией.
Количественные характеристики адсорбции
Для количественного описания адсорбции применяют три величины.
1. Избыточная, или гиббсовская адсорбция (Гі).
Это избыток і-го компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящийся на единицу площади поверхности.

где с8i и сi – молярная концентрация і-го компонента соответственно в поверхностном слое и в объеме фазы,
V8 – объем поверхностного слоя, который принято считать двухмерным и равным 1 см2, – площадь поверхностного слоя.
Учитывая, что молярная концентрация, умноженная на объем, – это количество вещества,

Абсолютная адсорбция.
В тех случаях, когда способность вещества к адсорбции резко выражена, и вследствие этого с8i>> сi, и υ8i>>υi, адсорбцию характеризуют величиной Ai называемой абсолютной адсорбцией.

где υ8i – количество вещества в поверхностном слое.
3. Удельная, адсорбция.
В тех случаях, когда измерить площадь поверхности S1,2 трудно, количество i-го компонента υ8i (или его массу m8i) относят к массе адсорбента m, используя величину удельной, адсорбции αi:

Если адсорбтивом является газ, вместо его количества (моль) или массы (кг) применяют его объем, исходя из того, что при нормальных условиях (0°С, 1 атм) 1 моль любого газа занимает объем, равный 22,4 дм3. Тогда удельная адсорбция измеряется дм3/кг.
Если Гi, Аi,αi> 0, адсорбцию называют положительной (в дальнейшем термином «адсорбция» будем называть именно положительную адсорбцию), если Гi, Аi,αi<0, то имеет место отрицательная адсорбция.
Классификация адсорбционных процессов
В зависимости от природы адсорбционных сил, адсорбция может быть физической и химической.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия.
Вы помните, что если молекулы полярны, возникают ориентационное, индукционное и дисперсионное взаимодействия. В случае неполярных молекул возможны только дисперсионные взаимодействия.
Особенности физической адсорбции:
1. Обратимость. Имеет место динамическое равновесие:
Сорбция↔Десорбция.
Десорбция обусловлена тепловым движением. Например, при адсорбции уксусной кислоты на угле на поверхности возникает адсорбционный комплекс:
поверхностный натяжение температура адсорбция

При десорбции комплекс разрушается и адсорбтив выделяется в химически неизменном виде.
2. Малая специфичность. На полярных адсорбентах адсорбируются полярные вещества, на неполярных – неполярные.
3. Незначительная теплота адсорбции (теплота, которая выделяется при адсорбции). Она составляет всего 8 – 40 кДж/моль, т.е. соизмерима с теплотой конденсации.
4. С повышением температуры адсорбция уменьшается:  так как увеличивается скорость десорбции.
так как увеличивается скорость десорбции.
Химическая адсорбция (хемосорбция) возникает в результате химической реакции между адсорбтивом и адсорбентом с образованием нового поверхностного соединения. Процесс происходит только на поверхности адсорбента.
Особенности химической адсорбции:
1. Необратимость. При десорбции с поверхности уходит поверхностное соединение. Десорбция обусловлена какими-то внешними воздействиями.
Например, адсорбция кислорода на угле:

При нагревании происходит десорбция

Специфичность. Адсорбция происходит, только если возможна химическая реакция.
2. Высокая теплота адсорбции, которая может достигать 800–1000 кДж/моль, т.е. сопоставима с тепловыми эффектами химических реакций.

Классификация в зависимости от агрегатного состояния адсорбента и адсорбтива
4. Повышение температуры приводит к увеличению хемосорбции, так как увеличивается скорость химического взаимодействия.
Заключение
Особенностью дисперсных систем является наличие большой межфазной поверхности. Молекулы, находящиеся на поверхности раздела фаз, вследствие нескомпенсированности действующих на них сил, обладают повышенной энергией. Мерой поверхностной энергии является поверхностное натяжение (а), равное термодинамически обратимой изотермической работе, которую необходимо затратить для увеличения площади межфазной поверхности на единицу. Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше поверхностное натяжение.
Любые процессы протекают самопроизвольно, если они сопровождаются уменьшением свободной энергии. Уменьшение свободной поверхностной энергии возможно либо за счет уменьшения величины межфазной поверхности, либо за счет уменьшения поверхностного натяжения. Стремление частиц принять сферическую форму, процессы коагуляции и коалесценции характерны для индивидуальных веществ, поверхностное натяжение которых постоянно. В тех случаях, когда постоянна площадь межфазной поверхности, самопроизвольно происходят процессы адсорбции – накопления в поверхностном слое частиц, понижающих поверхностное натяжение.
Дата добавления: 2015-08-17; просмотров: 653 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Зависимость поверхностного натяжения от температуры | | | Пять минут Смерти |