
Читайте также:
|
К щелочно-земельным элементам относятся металлы, которые дают щелочные оксиды. К ним относятся элементы второй группы Ве, Mg, Ca, Sr, Ba
[Ra] – радиоактивный, не имеет стабильных изотопов и получается в результате распада U и Th. 80-90% радиациии урановых руд
Be в расплаве в виде [BeO4]6-
Mg
Образует ок. 600-700 минеральных видов. В самородном виде встречается чрезвычайно редко, что противоречит его их свойствам. На поверхности имеет преиклазовую оболочку. Образует сульфиды, оксиды и т.д., но главное конечно же силикаты. Mg входит в состав таких минералов, как оливин, пироксены, амфиболы, слюды, серпентин, тальк, хлориты, карбонаты, рингвудит (ϒ – оливин, оливин со структурой шпинели)
Изотопы
24Mg – 78.99%
25Mg – 10% (стабильный)
26Mg – 11.01% (образуется из 26Al (вымерший, период полураспада ок.700 тыс.лет))
26Mg – космогенный изотоп
Mg – важнейший катион мантии. Главным образом в оливине, т.к. он самый тугоплавкий мин-л. При понижении давления поле оливина увеличивается и он кристаллизуется первым. В средних порода магний содержится в амфиболах и слюдах. В высокотемпературных гидротермах Mg связан с K/Mg отношение. Магний выносится и отношение растёт. В низкотремпературных гидротерамах Mg связывается и образуются хлориты. При взаимодействии морской воды (в которой много магния) с базальтами весь магний расходуется на образование вторичных минералов.
Количество Mg в океане высокое (его содержание примерно постоянно). Магний приносится в виде Mg2+ реками из выветриваемых пород. Расходуется: 1)образование карбонатов 2)MgSO4 0aq – (1/4 Mg) этот комплекс препятствует осаждению доломитов 3)хлориты и гальмиролиз
Доломиты и магнезиты образуются при захоранивании вод, поэтому доломиты являются наложенным процессов. Магний также участвует при эвапоритовом процессе (используется в качестве удобрений). Магнезиты образуются при выветривании УО пород.
Биофильный элемент – белковые ф-и организмов и хлорофил в растениях
Также, первые осадки быле не кальциевые, а магниевые
Са
40Са – 96.941% - β-распад 40К
Образует более 1000 минералов. В самородном виде не встречается. В метеоритах образует минерал ольдгамит (CaS). Для Са характерны сложные оксиды, фосфориты, силикаты (клинопироксен и плагиоклаз), фториды, карбонаты. Са часто определяет геохимию малых компонентов, например Р в апатитах, F во флюорите.
В хондритах Са – 1%(плагиоклазы), в ЗК 1-10% в базальтах (авгит +плагиоклаз) и 1% в кислых (плагиоклаз).
При выветривании Са оказывается в водных растворах и легко подвижен. Находится в виде иона
Океан CaCO3 ↓+H2O + CO2 = Ca2+ +2HCO3- суша
Почвенные газы на порядок более богаты углекислотой (0.1%) чем атмосфера (0.01%)
Выветривание происходит сильнее при большей площади суши и при наличии вулканизма.
Морская вода в целом насышена по кальцию, но химическим путём он не осаждается. Только с помощью животных, которые отлагают его локально. При увеличении глубины расворимость кальция растёт и на глубине осадки уже не образуются.
Са также выносится в гидротермах при воздействии с базальтами (связывается в эпидот)
До фанерозоя Са в океане в карбонатах практически не было, а теперь его много. С чем это связано не известно (но возможно из за изменения кислотности океана)
Минералы Са обладают ретроградной растворимостью (растворимость уменьшается при повышении температуры) (сульфаты, карбонаты, фосфиды)
Са – биофильный элемент. Скелет и электролиты в организме.
Sr
Химический аналог Са (имеет близкий радиус). Sr в 200 раз меньше Са. В магматических процессах Sr полный аналог Са. Sr/Са отношение растёт от основных пород к кислым.
Sr- известно ~20 минералов (карбонат, сульфат, борат, фторид,…)-целестин (SrSO4), Sr-апатит, пирохлор.
Лучше, чем Са обогащает расплавы. В щелочных породах Sr образуетсобственные минералы (лампрофиллит, Sr- апатит). В гидротермальных процессах: стронционит, целестин. При выветривании Sr оказывается в воде, мигрирует лучше Са, его много в морской воде (более прочный сульфатный комплекс?), извлекается живыми организмами. В высокотемпературных гидротермах рассеивается, т.к. при высоких температурах лучше идёт изоморфизм.
Sr в морской воде –> арагонит СаСО3+ Sr –> кальцит, Sr переходит в раствор
Гипс CaSO4*2H2O = CaSO4+2H2O ангидрит с водой (при диагенезе)–> CaSO4+ Sr в р-р.
↑Sr ↓SrSO4 целестин
Структура арагонита допускает Sr, а кальцита уже нет и образуется стронцианит. [Из морской воды Sr вып.в виде карбонатов => отн. Rb/Sr остаются неизменными (Rb в них не входит). ]
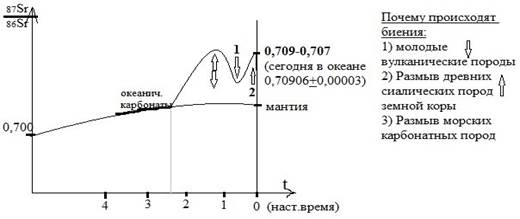
В цифре один присходит распад суперконтинетов.
Sr для жизни вреден (замещает Са в костях). Для него есть несколько изотопов, самый вредный 90Sr: 235U –> 2 осколка (2:3, 2 – 90Sr) + Xn0
90Sr t1/2=28 лет (попадает в кости, не выводится из организма, облучает костный мозг, всё плохо). Аварии: Кыштым, Чернобыль.
Sr легко выносится из костей, поэтому если его в костях много, они становятся хрупкими при выносе стронция. (образует лиганды) и мы болеем. Поэтому нельзя делать удобрения из высокотемпературных магматических апатитов.Строниций труднолетучий.
Используется для фейверков.
Ba
Изотопы: 130Ba, 132Ba, 134Ba, 135Ba, 137Ba, 138Ba (71,66%)
Содержание: Земная кора - 500 г/т; Хондриты - 9 г/т.
Минералы: барит BaSO4, витерит BaCO3, цельзиан Ba[Al2Si2O8], гиалофан –удвоенная структура K2Ba[Al2Si4O12]
Ва большой, поэтому более близок К, а не Са (входит в КПШ)! Ряд Pb2+ – Ba2+ – K2+
BaSO4 – плохо растворим, в безсульфатных водах Ba2+ хорошо переносится => на окислительном барьере образуется барит.
Ва чрезвычайно токсичен для организма, но довольно трудно получить растворимые соли Ва. Он остается в костях и не выводится. Очень жаль. Окрашивает фейерверк в зеленый.
В магматических процессах барий накапливается.
косвенная связь с марганцем. сульфат исчезает, восстанов условия марганец переходит в 2+. Сульфат бария не растворим (один из не многих), при его исчезновении Ва становитс подвижным. И марганец тоже подвижный т.к. переходит в +2. Т.е. подвижности косвенно связаны
Дата добавления: 2015-08-17; просмотров: 179 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Растворимые формы кремнекислоты, ее поведение. Диатомит. Осадочный цикл кремния. Роль кремния в биосфере. | | | Геохимия Mo. Отношение к W. Легколетучие соединения Mo, формы нахождения в гидротермальном процессе. Биогеохимические провинции. |