
Читайте также:
|
Российский национальныйисследовательскиймедицинский университетимени Н. И. Пирогова
Кафедра Биологической химии
Реферат на тему:
Вторичные посредники. Типы и роль во внутриклеточной передаче сигнала
Выполнил студент 2-го курса 213 группы Лечебного факультета Парсаданян Гайк Каренович
2012г.
г. Москва
Оглавление
1. Введение………………………………………………………………………………………………………………..….. 2
2. Мембранные рецепторы………………………………………………………………………………………….. 4
· Виды мембраносвязанных рецепторов………………………………………………… 5
· Структура мембранных рецепторов………………………………………………………. 6
3. Основные этапы передачи гормональных сигналов……………………………………………... 6
4. ГТФ-связывающие белки (G-белки)…………………………………………………………………..…….. 7
5. Вторичные посредники и механизмы их действия………………………………………….……. 8
Циклический АМФ ……………………………………………………………………………..…………... 9
· G-белок и аденилатциклаза…………………………………………………………..………. 9
· Синтез и расщепление цАМФ………………………………………………………….……. 11
· Этапы передачи сигнала………………………………………………………………….……. 12
· цАМФ-зависимая протеинкиназа…………………………………………………….…… 14
· цАМФ-регулируемые протеинфосфатазы…………………………………………….. 14
· Биохимическая модель действия цАМФ……………………………………………… 15
· Множественный эффект цАМФ…………………………………………………………….. 16
Са2+ - вторичный посредник …………………………………………………………………….……. 17
· Белки, связывающие кальций………………………………………………………..….…. 18
· Механизм действия……………………………………………………………………………….. 19
· Процессы или ферменты, регулируемые комплексом Ca2+ с кальмодулином……………………………………………………………….………. 20
· Взаимодействие цАМФ и Са2+………………………………………………………………. 21
Фосфоинозитидный путь передачи сигнала ……………………………………………….. 22
· Механизм действия……………………………………………………………………………….. 22
· Фосфолипаза С………………………………………………………………………………………… 24
· Инозитолтрифосфат………………………………………………………………………………… 25
· Диацилглицерол…………………………………………………………………………………….. 25
· Протеинкиназа С…………………………………………………………………………………….. 25
· Множественные эффекты фосфоинозитидного пути…………………………… 26
Циклический ГМФ …………………………………………………………………………………………… 26
6. Заключение……………………………………………………………………………………………………….………. 28
7. Список литературы……………………………………………………………………………………………….…… 30
Введение
Одним из важнейших этапов прогрессивной эволюции явилось возникновение многоклеточных организмов, у которых разные типы тканей выполняют различные функции. Клетки любого многоклеточного организма нуждаются в обмене информацией друг с другом – для регуляции своего развития и организации в ткани, для контроля процессов роста и деления и для координации функций – одним словом, для выживания организма в целом. У многоклеточных животных сформировались два вида такой связи. Один вид – быстрая передача электрохимических сигналов нервной системой из одной части организма в другую. Второй вид связи основан на том, что нервная система и другие специализированные ткани выделяют в общую циркуляцию особые вещества для передачи сигналов отдаленным органам. Без таких молекулярных посредников и регуляторов была бы невозможна ежеминутная и повседневная координация функций различных органов и тканей. Подобно тому, как мышечная активность невозможна без координации и контроля, осуществляемых нервной системой с помощью электрических сигналов, так и рост, поддержание стационарного состояния и размножение невозможны без координации и контроля, осуществляемых внеклеточными и внутриклеточными посредниками.
Можно сказать еще, что взаимодействие животных клеток осуществляется следующими тремя способами:
1. Клетки выделяют химические вещества, служащие сигналами для других клеток, расположенных на некотором расстоянии.
2. Клетки несут на своей поверхности связанные с плазматической мембраной сигнальные молекулы, оказывающие влияние на другие клетки при непосредственном физическом контакте.
3. Клетки образуют щелевые контакты, прямо соединяющие цитоплазму двух взаимодействующих клеток, что делает возможным обмен малыми молекулами.
В любом случае, нас интересует тот путь коммуникации на расстоянии, которая осуществляется с помощью секретируемых химических сигналов. И тут можно добавить, что химические сигнальные механизмы различаются по расстояниям, на которых они действуют:
1. Аутокринная регуляция - клетка выделяет вещества, которые оказывают специфическое действие на ту же клетку.
2. Паракринная регуляция – клетки выделяют локальные химические медиаторы, которые поглощаются, разрушаются или иммобилизируются так быстро, что успевают подействовать путем диффузии только на клетки ближайшего окружения.
3. Нейрокринная регуляция – выделение нейронами нейромедиаторов в специализированные межклеточные контакты, называемые химическими синапсами; данный способ сигнализации используется только в нервной системе.
4. Эндокринная сигнализация – специализированные эндокринные клетки выделяют гормоны, которые разносятся кровью и воздействуют на клетки-мишени, находящиеся иногда в самых разных частях организма; если при этом посредник секретируется в кровь нервными клетками, то речь идет о функции нейроэндокринной системы.
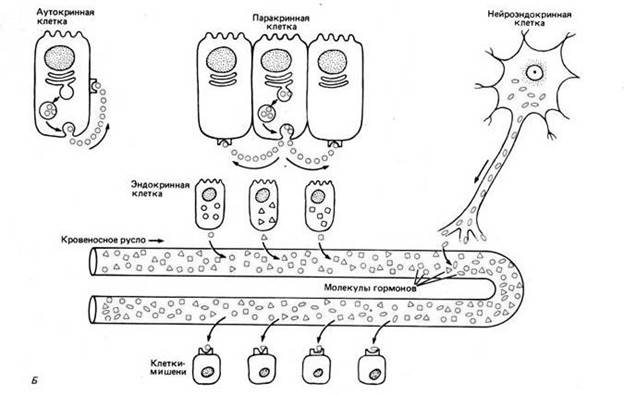
В каждом случае мишень реагирует на определенный внеклеточный сигнал с помощью специальных белков, называемых рецепторами, которые связывают сигнальную молекулу и инициируют ответ. Главные различия между этими путями касаются быстроты и избирательности воздействия сигнала на определенные мишени. К примеру, нейромедиаторы – посредники, выделяемые нервными клетками, – действуют на небольшом расстоянии, активируя рецепторы постсинаптических клеток. Гормоны же передают сигнал на более далекие расстояния, обычно через кровеносную систему и межклеточную жидкость, поэтому сигнал передается гораздо медленнее.
Мембранные рецепторы
Для регуляции деятельности клетки с помощью гормонов, находящихся в плазме крови, необходимо обеспечить возможность клетки воспринимать и обрабатывать этот сигнал. Эта задача усложняется тем, что сигнальные молекулы (нейромедиаторы, гормоны) имеют разную химическую природу, реакция клеток на сигналы должна быть различной по направленности и адекватной по величине.
В связи с этим, эволюционно сформировались два основных механизма действия сигнальных молекул по локализации рецептора:
1. Цитозольный – рецептор расположен в цитозоле. По данному механизму работают стероидные и другие липофильные гормоны; по–видимому, воздействуют внутри клетки на генетический аппарат. Эти гормоны называют внеклеточными и первыми посредниками.
2. Мембранный – рецептор расположен на мембране. Для этих рецепторов в зависимости от способа передачи гормонального сигнала в клетку выделяют три видамембраносвязанных рецепторов и, соответственно, три механизма передачи сигнала. По данному механизму работают пептидные и белковые гормоны, катехоламины, эйкозаноиды. Проявляются более быстрые и кратковременные реакции, влияя, как правило, на обмен веществ. Действие гормонов прекращается вскоре после их недолговременного присоединения к белковым рецепторным молекулам на поверхностных мембранах клеток–мишеней. Взаимодействие гормона с рецептором ведет к запуску внутриклеточного каскадного механизма (т. е. к цепи реакций, усиливающих исходный сигнал), что приводит к образованию внутриклеточного регулятора в цитозоле клетки. Молекулу (или комплекс молекул) внутриклеточного регулятора, образующуюся после взаимодействия гормона с рецептором, называют внутриклеточным или вторым посредником.
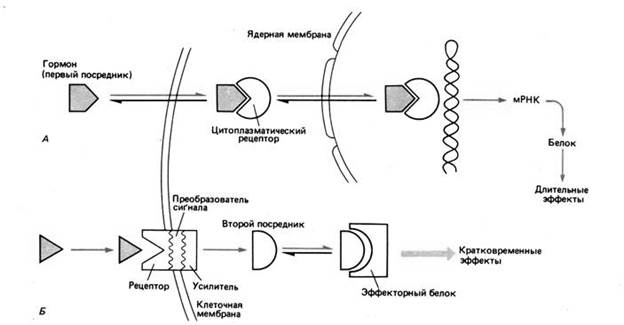
На следующем рисунке:
A. Жирорастворимый гормон проходит через мембрану и, присоединившись внутри клетки к молекуле рецептора, образует активный комплекс, который воздействует на генетический аппарат.
B. Гормон, нерастворимый в жирах, присоединяется к рецептору на поверхности клетки и стимулирует ферментативное образование второго посредника, который, связавшись с другой молекулой, образует с ней метаболически активный комплекс.
Виды мембраносвязанных рецепторов
1. Рецепторы, обладающие каталитической активностью – при взаимодействии лиганда с рецептором активируется внутриклеточная часть (домен) рецептора, имеющий тирозинкиназную или тирозинфосфатазную или гуанилатциклазную активность. По этому механизму действуют инсулин, пролактин, интерлейкины, ростовые факторы, интерфероны α, β, γ.
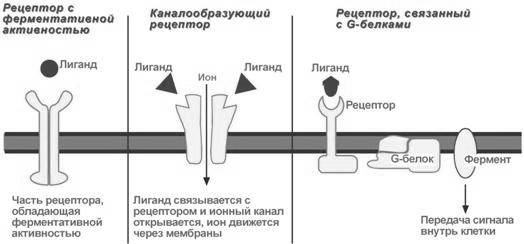
Три механизма передачи сигнала в зависимости от вида мембранных рецепторов
2. Каналообразующие рецепторы – присоединение лиганда к рецептору вызывает открытие ионного канала на мембране. Таким образом действуют нейромедиаторы (ацетилхолин, глицин, ГАМК, серотонин, гистамин, глутамат).
3. Рецепторы, связанные с G-белками – передача сигнала от гормона происходит при посредстве G-белка. G-белок влияет на ферменты, образующие вторичные мессенджеры (посредники). Последние передают сигнал на внутриклеточные белки. Большинство гормонов действуют по данному механизму.
Структура мембранных рецепторов. Рецепторы по своей химической природе являются белками и, как правило, состоят из нескольких доменов.
В структуре мембранных рецепторов можно выделить три функционально разных участка. Первый домен (домен узнавания) расположен в N-концевой части полипептидной цепи на внешней стороне клеточной мембраны; он содержит гликозилированные участки и обеспечивает узнавание и связывание гормона. Второй домен – трансмембранный. У рецепторов, сопряженных с G-белками, он состоит из семи плотно упакованных α-спиральных полипептидных последовательностей. Третий домен (цитоплазматический) создает химический сигнал в клетке, который сопрягает узнавание и связывание гормона с определенным внутриклеточным ответом.
Связывание гормона (первичного посредника) с рецептором приводит к изменению конформации рецептора (это изменение улавливается другими макромолекулами), образуется комплекс гормон-рецептор, который трансформирует сигнал первичного посредника в изменение концентрации вторичных посредников.
Основные этапы передачи гормональных сигналов.
В общих чертах пути передачи сигнала с участием G-белков – протеинкиназ включают следующие этапы:
1. Гормон или иная регуляторная молекула связывается с рецептором на плазматической мембране.
2. Связанные с лигандом рецептор, взаимодействуя с G-белком, активирует его, и активированный G-белок связывает ГТФ.
3. Активированный G-белок взаимодействует с одним или несколькими следующими соединениями:аденилатциклазой,гуанилатциклазой, фосфолипазой С, Ca2+- или К+-каналами. При этом он активирует или ингибирует их.
4. Внутриклеточный уровень одного или нескольких вторичных мессенджеров возрастает или снижается.
5. Увеличение или уменьшение концетрации вторичного мессенджера влияет на активность одной или нескольких зависимых от него протеинкиназ, таких как цАМФ-зависимая протеинкиназа, цГМФ-зависимая протеинкиназа, кальмодулинзависимая протеинкиназа, протеинкиназа С. Изменение концентрации вторичного посредника активирует ионный канал.
6. Изменяется уровень фосфорилирования фермента или ионного канала, или активность ионного канала, и это обусловливает конечный ответ клетки.

Основными вторичными посредниками являются: циклический АМФ (цАМФ), циклический ГМФ (цГМФ), Ca2+, инозитол-1,4,5-трифосфат (IP3) и диацилглицерины (DAG).
ГТФ-связывающие белки (G-белки)
ГТФ-связывающие белки связывают и гидролизуют ГТФ. Они служат молекулярными переключателями, регулирующими множество внутриклеточных процессов. Активная форма G-белка отличается высоким сродством к ГТФ. Обладая собственной ГТФазной активностью, G-белки гидролизуют ГТФ, переходя при этом в неактивную ГДФ-связанную форму. Активные G-белки, связываясь и модифицируя активность определенных ферментов и ионных каналов, модулируют множество жизненно важных клеточных процессов. Известно два класса G-белков – гетеротримерные G-белки (именно они нас интересуют) и мономерные ГТФ-связывающие белки.
Гетеротримерный G-белок состоит из трех субъединиц: α (40 000 – 45 000 Да), β (около 37 000 Да) и γ (8 000- 10 000 Да). Сейчас известно около 20 различных генов, которые кодируют эти субъединицы. Функция и специфичность G-белка обычно, хотя и не всегда, определяются его α-субъединицей. У большинства из них субъединицы β и γ прочно связаны между собой.
Гетеротримерные G-белки служат посредниками между рецепторами плазматической мембраны для более 100 внеклеточных регуляторных веществ и внутриклеточными процессами, которые они контролируют. Связывание регуляторного вещества с го рецептором активирует G-белок, а тот либо активирует, либо ингибирует фермент или ионный канал.
В большинстве G-белков α-субъединица представляет собой «рабочий элемент» гетеротримерных G-белков. Активация большинства G-белков приводит к конформационному изменению этой субъединицы. Неактивные G-белки существуют главным образом в форме αβγ-гетеротримеров с ГДФ в участках, связывающих нуклеотид. Взаимодействие гетеротримерных G-белков с присоединившим лиганд рецептором ведет к преобразованию α-субъединицы в активную форму, которая имеет повышенное сродство к ГТФ и пониженную аффиность в βγ-комплексу. В результате активированная α-субъединица освобождает ГДФ, присоединяет ГТФ, а затем диссоциирует от βγ-димера. У большинства G-белков диссоциированная α-субъединица взаимодействует с эффекторными белками при передаче сигнала. Однако у некоторых из них освободившийся βγ-димер может быть ответственным за все или некоторые эффекты рецепторлигандного комплекса.
Вторичные посредники и механизмы их действия
Выше уже были перечислены основные вторичные посредники, которые далее будут рассмотрены более подробно. И хоть все они имеют много общего в плане функционирования и механизмов действия, начиная от присоединения гормонов к рецептору, заканчивая теми или иными изменения метаболизма клетки, но каждый из них имеет много индивидуальных особенностей, начиная от структуры и заканчивая способом действия. Именно индивидуальные особенности каждого вторичного посредника будут рассмотрены далее.
Циклический АМФ
В середине 1950-годов Э.У.Сазерленд и его команда достигли фундаментального достижения в биологии – они открыли цАМФ. Оно имело огромное значение для многих областей биохимии и биологии клетки и открыло путь к совершенно новому пониманию многих регуляторных процессов. За открытием Сазерленда последовало накопление огромной массы данных, полученных на многих типах клеток и подтверждавших универсальность и важное значение цАМФ как внутриклеточного регулятора.
Циклический АМФ (цАМФ) образуется в клетке, когда действуют гормоны гипофиза (ТТГ, ЛГ, МСГ, ФСГ, АКТГ), кальцитонин, соматостатин, глюкагон, паратгормон, адреналин (через α2- и β-адренорецепторы), вазопрессин (через V2-рецепторы).
Открытие связанного с мембраной фермента аденилатциклазы явилось первым указанием на существование связи между внеклеточными гормонами и внутриклеточными молекулами–посредниками и привело к созданию гипотезы о втором посреднике. Согласно этой гипотезе, молекула гормона взаимодействует со специфическим рецептором, выступающим над наружной поверхностью мембраны клетки–мишени; это вызывает конформационные изменения рецептора, что в свою очередь приводит к аллостерической активации фермента, находящегося на внутренней поверхности мембраны. Исследование аденилатциклазной системы показало, что рецептор гормона непосредственно с аденилатциклазой не реагирует, а действует на передающий сигнал белок, который и активирует аденилатциклазу. Активная аденилатциклаза катализирует гидролиз АТР с образованием цАМФ. Превращение АТР в цАМФ требует присутствия Mg2+ и следов Cа2+. А белок, который активирует аденилатциклазу, - это G-белок.
Таким образом, сигнал передается через мембрану путем взаимодействия трех встроенных в мембрану белков – рецептора, G–белка и аденилатциклазы. Последняя обеспечивает первый этап усиления за счет образования из АТР большого числа молекул второго посредника – цАМФ – на каждую молекулу первого посредника. Второй посредник воздействует на внутриклеточный эффектор, который обеспечивает второй этап усиления, но об этом будет рассказано чуть дальше.
G-белок и аденилатциклаза. G-белок как активирует аденилатциклазу, так может ее и ингибировать, и именно поэтому различают стимулирующий G-белок (Gs) и ингибиторный G-белок (Gi).
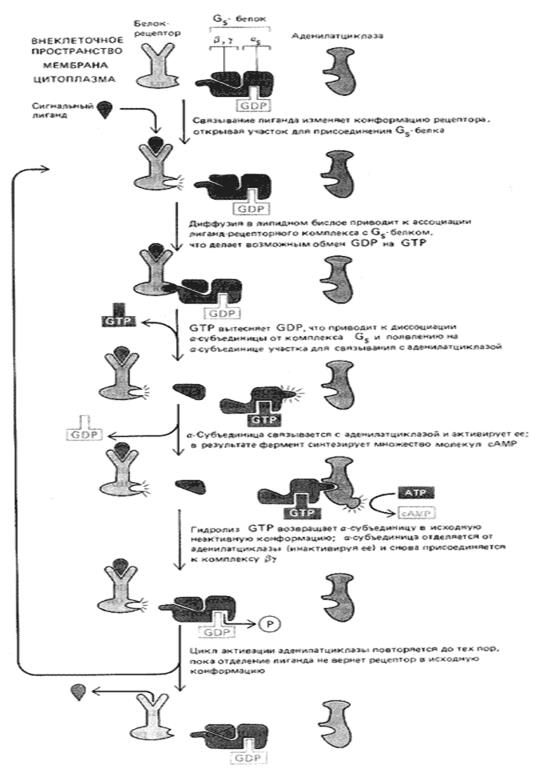
Функция Gs-белка решающим образом зависит от его субъединичной структуры. В его состав входят три полипептида: α-цепь, которая связывает и гидролизует ГТФ и активирует аденилатциклазу, и прочный комплекс β-цепи и γ-цепи, который заякоривает Gs на внутренней стороне цитоплазматической мембраны (см. рисунок выше).
Одна и так же сигнальная молекула может как повышать, так и понижать внутриклеточную концентрацию цАМФ в зависимости от типа рецептора, с которым она связывается. Например, есть несколько типов рецепторов для адреналина: β-адренэргические рецепторы активируют аденилатциклазу, а α2-адренэргические ингибируют ее. Различный конечный эффект определяется G-белками, осуществляющими сопряжение этих рецепторов с аденилатциклазой: β-рецепторы действуют через Gs, а α2-рецепторы – через ингибиторный Gi-белок, который содержит тот же βγ-комплекс, что и Gs, но другую α-субъединицу. Будучи активирован, α2-адренэргический рецептор взаимодействует с Gi, приводя к замене ГДФ на ГТФ в участке связывания гуаниловых нуклеотидов на α-субъединице. При этом, как полагают, α-субъединица отделяется от βγ-комплекса, и обе эти субъединицы участвуют в ингибировании аденилатциклазы: α-субъединица прямо подавляет активность аденилатциклазы, тогда как действие βγ-комплекса обусловлено связыванием свободной α-субъединицы Gs-белка и, как следствие, устранением ее активирующего влияния на аденилатциклазу.
Синтез и расщепление цАМФ. Идентификация циклического АМФ привела к изучению ферментов, участвующих в его синтезе и разрушении. Чтобы цАМФ мог служить внутриклеточным посредником, его концентрация в клетке должна быть подвержена быстрым изменениям в ту или другую сторону под действием определенных внеклеточных сигналов (при гормональной стимуляции она может за несколько секунд увеличиваться в 5 раз). Для этого быстрый синтез молекул должен уравновешиваться быстрым их расщеплением и удалением. Циклический АМФ синтезируется из АТФ ферментом аденилатциклазой, связанным с плазматической мембраной клетки, но быстро расщепляется одним или несколькими ферментами – цАМФ-фосфодиэстеразами, которые гидролизуют его до аденозин-5'-монофосфата (5'-АМФ).
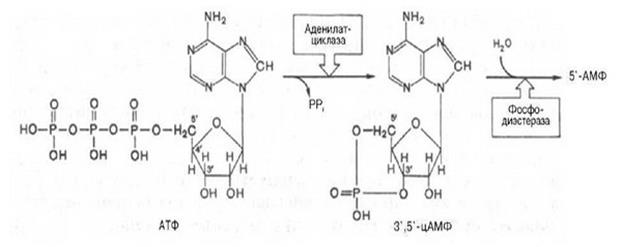
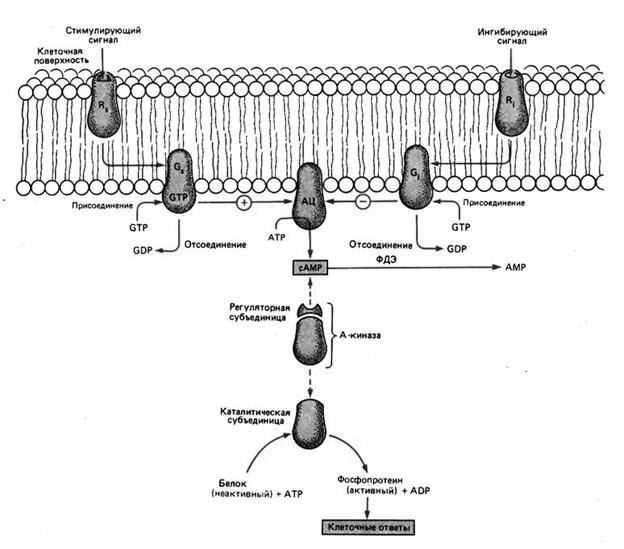
Этапы передачи сигнала. Этапы передачи сигнала выглядят следующим образом:
На следующем рисунке представлен каскад с цАМФ. Гормоны или иные лиганды, оказывающие стимулирующее или ингибирующее действие, связываются соответственно с рецепторами Rs или Ri, и образующиеся комплексы катализируют присоединение ГТФ к соответствующим белкам Gs или Gi, передающим сигнал. G–белки, активированные ГТФ, приобретают способность стимулировать или подавлять каталитическую активность аденилатциклазы (АЦ) до тех пор, пока не произойдет ферментативный гидролиз ГТФ до ГДФ, после чего действие аденилатциклазы прекращается. Активированная АЦ катализирует синтез цАМФ из АТФ. цАМФ активирует протеинкиназу, отщепляя от нее регуляторную субъединицу и освобождая каталитическую субъединицу, которая приобретает теперь способность фосфорилировать различные внутриклеточные фосфопротеины, что приводит к их активации. Таким образом, увеличение концентрации цАМФ под действием гормона вызывает в клетке ответы, характер которых зависит от природы активированных протеинкиназой А фосфопротеинов, присутствующих в клетке–мишени. После активации протеинкиназы А цАМФ расщепляется до АМФ фосфодиэстеразой (ФДЭ).
цАМФ-зависимая протеинкиназа. В животных клетках цАМФ действует главным образом путем активации специфического фермента, называемого цАМФ-зависимой протеинкиназой или протеинкиназой А. Этот фермент катализирует перенос концевого фосфата с АТФ на определенный остатки серина и треонина в некоторых белках клетки-мишени. Остатки, фосфорилируемые протеинкиназой А, отличаются тем, что со стороны N-конца около них расположены две или большее число основных аминокислот. Ковалентное фосфорилирование таких остатков в свою очередь регулируют активность этих белков.
В отсутствие цАМФ протеинкиназы А состоят из четырех субъединиц – двух регуляторных и двух каталитических. У большинства типов клеток каталитическая субъединица одна и так же, зато регуляторные субъединицы высокоспецифичны. Присутствие регуляторных субъединиц почти полностью подавляет ферментативную активность комплекса. Таким образом, активация ферментативной активности цАМФ-зависимой протеинкиназы должна происходить за счет отделения регуляторных субъединиц от комплекса.
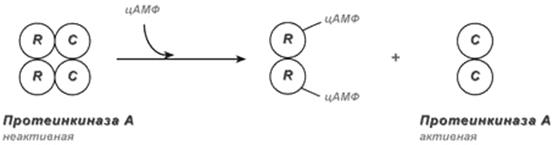
Активация происходит в присутствии микромолярных концентраций цАМФ. Каждая регуляторная субъединица связывает две его молекулы. Связывание цАМФ индуцирует конформационные изменения в регуляторных субъединицах и снижает аффиность их связывания с каталитическими субъединицами. В результате этого регуляторные субъединицы отделяются от каталитических, и каталитические субъединицы становятся активированными. Активная каталитическая субъединица фосфорилирует белки-мишени по определенным сериновым и треониновым остаткам.
цАМф-регилируемые протеинфосфатазы. Так как эффекты цАМФ обычно непродолжительны, ясно, что клетка способна дефосфорилировать белки, фосфорилированные протеинкиназой А. Отщепление фосфата катализируют две главные протеинфосфатазы, одна из которых сама регулируется цАМФ. Уровень фосфорилирования всегда будет зависеть от баланса между активностями киназ и фосфатаз.
В клетках скелетных мышц цАМФ-регулируемая протеинфосфатаза наиболее активна в отсутствии цАМФ, и она дефосфорилирует все три ключевых фермента метаболизма гликогена – киназу фосфорилаз, гликогенфосфорилазу и гликогенсинтазу. Это дефосфорилирование противодействует фосфорилированию белков под действием цАМФ. Однако протеинкиназа А в активном состоянии фосфорилирует и тем самым активирует также специальный белок – ингибитор фосфатазы. Этот белок присоединяется к фосфопротеинфосфатазе и инактивирует ее. Таким образом, протеинкиназа А, активируя киназу фосфорилазы и одновременно подавляя активность протеинфосфатазы, намного усиливает и ускоряет воздействие повышенного уровня цАМФ на синтез и распад гликогена по сравнению с тем, что было бы, если бы протеинкиназа А действовала лишь на один из этих ферментов. Этим и обеспечивается второй этап усиления, а котором упоминалось выше.
Биохимическая модель действия цАМФ как вторичного посредника. Впервые цАМФ-зависимое фосфорилирование белков было выявлено при изучении метаболизма гликогена в клетках скелетных мышц. Гликоген – это основная резервная форма глюкозы; его распад в мышечных клетках регулируется адреналином (фактически адреналин регулирует как распад гликогена, так и его синтез в скелетной мускулатуре). Если, например, животное подвергнуть стрессу (испугать и т.п.), то надпочечники начнут выбрасывать адреналин в кровь, и это будет приводить различные ткани организма в состояние «готовности». Циркулирующий в крови адреналин вызывает, в частности, расщепление гликогена в мышечных клетках до глюкозо-1-фосфата и в то же время подавляет синтез нового гликогена. Глюкозо-1-фосфат превращается в глюкозо-6-фосфат, который затем окисляется в реакциях гликолиза с образованием АТФ, обеспечивая энергию для интенсивной работы мышц. Таким способом адреналин подготавливает мышечные клетки к усиленной работе.
На поверхности мышечных клеток адреналин связывается с β-адренэргическими рецепторами, что ведет к активации аденилатциклазы и повышению уровня цАМФ в цитозоле. цАМФ активирует протеинкиназу А, и она фосфорилирует другой фермент – киназу фосфорилазы. Эта последняя в свою очередь фосфорилирует (и тем саамы активирует) гликогенфосфорилазу, отщепляющую остатки глюкозы от молекулы гликогена. Активированная протеинкиназа А, кроме того, усиливает фосфорилирование гликогенсинтазы – фермента, осуществляющего последний этап синтеза гликогена из глюкозы, фосфорилирование инактивирует гликогенсинтазу и прекращает синтез гликогена.
Известно также, что гормон глюкагон вызывает расщепление гликогена в печени. В присутствии глюкагона в печени активируется аденилатциклаза и соответственно повышается содержание цАМФ, который также способствует расщеплению гликогена до глюкозо–6–фосфата, подавляет синтез гликогена из глюкозы и стимулирует образование глюкозы из лактата и аминокислот. Конечный результат состоит в повышении уровня глюкозы в крови. С помощью такого каскада взаимодействий повышения уровня цАМФ приводит одновременно как к уменьшению синтеза гликогена, так и к усилению его распада, что максимально увеличивает количество глюкозы, доступной для использования клеткой.
Множественные эффекты цАМФ.
Дата добавления: 2015-08-17; просмотров: 878 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Вибір автомата при змішаному навантаженні | | | Реакции клеток различных тканей на внешние сигналы с участием цАМФ |