
Читайте также:
|
| Сигнал | Ткань | Реакция клетки |
| Стимулирующий | ||
| Адреналин | Скелетная мышца | Расщепление гликогена |
| Жировые клетки | Усиленное расщепление жиров | |
| Сердце | Увеличение частоты и силы сокращений | |
| Кишечник | Секреция жидкости | |
| Гладкая мускулатура | Расслабление | |
| Тиреотропный гормон | Щитовидная железа | Секреция тироксина |
| Вазопрессин | Почки | Реабсорбция воды |
| Глюкагон | Печень | Расщепление гликогена |
| Серотонин | Слюнная железа (у мясной мухи) | Секреция жидкости |
| Простогландин I1 | Тромбоциты | Подавление агрегации и секреции |
| Ингибирующий | ||
| Адреналин (α2–рецепторы) | Тромбоциты | Стимуляция агрегации и секреции |
| Жировые клетки | Уменьшение расщепления жиров | |
| Аденозин | Жировые клетки | Уменьшение расщепления жиров |
Ca2+ - вторичный посредник
Так же как и цАМФ, Са2+, возможно один из важных внутриклеточных посредников, появляющийся в результате активации рецепторов клеточной поверхности. И он точно также действует как аллостерический эффектор – активирует определенные белки, присоединяясь к ним и изменяя конформацию. Выявлены два типа передачи сигнала с участием ионов Са2+, один из которых реализуется главным образом в электрически активных клетках, а другой – почти во всех клетках эукариот. Первый встречается на нервных клетках, где деполяризация плазматической мембраны вызывает поглощение Са2+ нервным окончание, инициируя секрецию нейромедиатора; Са2+ входит через потенциал-зависимые кальциевые каналы, которые открываются при деполяризации плазматической мембраны нервного окончания в момент прихода потенциала действия. При втором способе связывание сигнальной молекулы с рецептором клеточной поверхности ведет к освобождению Са2+ из внутриклеточных хранилищ; события на поверхности клетки сопряжены с открытием кальциевых каналов во внутриклеточной мембране с помощью другого внутриклеточного посредника – инозитолтрифосфата. Он образуется в плазматической мембране в результате быстрого гидролиза минорных фосфолипидов (инозитолфосфолипидов), об этом будет рассказано немного позже.
Концентрация свободных ионов Ca2+ в цитозоле клеток очень низка, тогда как концентрация их во внеклеточной жидкости и в специальном внутриклеточном запасающем Са2+ компартменте довольно высока. Столь значительный градиент ионов стремиться проталкивать их в цитозоль через плазматическую мембрану и мембрану запасающих внутриклеточных органелл. Когда какой-то сигнал на короткое время открывает в этих мембранах Са2+-каналы, ионы кальция буквально врываются в цитозоль, резко повышая свою локальную концентрация и активируя чувствительные к ним механизмы в клетке.
Для работы этого сигнального механизма в цитозоле должна поддерживаться низкая концентрация Ca2+,и это достигается несколькими путями:
1. Са2+-зависимая АТФаза, которая использует энергию расщепления АТФ для откачивания ионов Са2+ из цитозоля;
2. Кальциевый насос, который связывает выход Са2+ с поступлением в клетку Na+.
3. Са2+-АТФаза специализированны органелл – способная закачивать в органеллы большие количества ионов кальция из цитозоля против крутого градиента концентрации даже тогда, когда их уровень в цитозоле низок.
 Белки, связывающие кальций. Молекулы ряда белков избирательно связывают ионы кальция, и некоторые из них служат внутриклеточными рецепторами кальция при выполнении им роли посредника. Первый из открытых белковых рецепторов Са2+ – тропонин С, важный регуляторный белок поперечнополосатых мышц позвоночных. Когда этот белок связывает Са2+, увеличивается степень спирализации его пептидной цепи. Это конформационное изменение инициирует ряд процессов, приводящих к сокращению мышц. Тропонин С найден только в поперечнополосатых мышцах. Однако во всех исследованных тканях эукариот присутствует в относительно больших количествах очень сходный с ним белок, связывающий Са2+, – кальмодулин.
Белки, связывающие кальций. Молекулы ряда белков избирательно связывают ионы кальция, и некоторые из них служат внутриклеточными рецепторами кальция при выполнении им роли посредника. Первый из открытых белковых рецепторов Са2+ – тропонин С, важный регуляторный белок поперечнополосатых мышц позвоночных. Когда этот белок связывает Са2+, увеличивается степень спирализации его пептидной цепи. Это конформационное изменение инициирует ряд процессов, приводящих к сокращению мышц. Тропонин С найден только в поперечнополосатых мышцах. Однако во всех исследованных тканях эукариот присутствует в относительно больших количествах очень сходный с ним белок, связывающий Са2+, – кальмодулин.
Кальмодулин функционирует как многоцелевой внутриклеточный рецептор для Са2+, участвующий в большинстве процессов, регулируемых этими ионами. Это одиночный полипептид примерно из 150 аминокислот, имеющий четыре высокоаффинных Са2+-связывающих центра; при связывании кальция он претерпевает большие конформационные изменения.
Аллостерическая активация кальмодулина кальцием аналогична активации протеинкиназы А циклическим АМФ, с тем отличием, что комплекс Са2+-кальмодулин сам по себе не обладает ферментативной активностью и действует, связываясь с другими белками. В некоторых случаях кальмодулин служит постоянной регуляторной субъединицей ферментного комплекса, но чаще всего связывание Са2+ ведет к присоединению кальмодулина к различным белкам-мишеням и, как следствие, к изменению их активности.

Механизм действия. К числу мишеней, регулируемых комплексом Са2+-кальмодулин, относится много ферментов и мембранных транспортных белков. Среди них выделяются Са2+/кальмодулин-зависимые протеинкиназы (Са-киназы), фосфорилирующие белки по остаткам серина и треонина. Первые из открытых Са-киназ – киназа легких цепей миозина и киназа фосфорилазы – имели узкую субстратную специфичность. Позже была идентифицирована широкоспецифичная Са-киназа, называемая Са2+/кальмодулин-регулируемой «полифункциональной» киназой (или Са-киназой II); она может служить посредником во многих эффектах Са2+ в клетках млекопитающих. Как и в случае цАМФ, ответ клетки-мишени на повышение концентрации свободного кальция в цитозоле определяется тем, какие Са2+/кальмодулин-регулируемые белки имеются в клетке.
На рисунке ниже представлен кальциевый каскад. Специфические кальциевые каналы плазматической мембраны (или эндоплазматического ретикулума) активируются (стадия 2) таким стимулом (стадия 1), как деполяризация мембраны или химический посредник (например, внеклеточный гормон или внутриклеточный посредник типа ИФ3). Это позволяет ионам кальция проходить внутрь клетки по каналам в направлении электрохимического градиента, благодаря чему местная концентрация ионов Ca2+ в цитозоле увеличивается с <10–7 М (уровень в покое) до > 10 –6 М. Повышение концентрации ионов кальция может активировать несколько путей внутриклеточной регуляции, включая активацию таких Са2+/кальмодулин–зависимых ферментов, как Ca2+ /кальмодулин–зависимая протеинкиназа, что приводит к разнообразным клеточным ответам. Имеются также данные о том, что повышение концентрации ионов Ca2+ стимулирует образование цГМФ и последующую активацию цГМФ–зависимой протеинкиназы.

Процессы или ферменты, регулируемые комплексом Ca2+ с кальмодулином.

Взаимодействие цАМФ и Са2+. Пути с участием вторичных посредников цАМФ и Са2+ взаимодействуют, по крайней мере, тремя способами:
1. Внутриклеточные уровни кальция и цАМФ влияют друг на друга. Например, комплексы кальций-кальмодулин связываются с ферментами, которые разрушают или синтезируют цАМФ, – с цАМФ-фосфодиэстеразой и аденилатциклазой соответственно – и регулируют их активность; а свою очередь протеинкиназа А способна фосфорилировать некоторые кальциевые каналы и насосы и изменять их активность.
2. Некоторые Са-киназы фосфорилируются протеинкиназой А.
3. Протеинкиназа А и Са-киназы нередко фосфорилируют различные участки одного белка, который таким образом регулируется сразу и цАМФ, и кальцием.
Примером является киназа фосфорилазы скелетных мышц, роль которой – расщепление гликогена (смотреть выше): она фосфорилирует гликогенфосфорилазу, расщепляющую гликоген. Киназа фосфорилазы – мультисубъединичный фермент, но только одна из его четырех субъединиц фактически катализирует фосфорилирование: три другие регуляторные и дают комплексу возможность активироваться и цАМФ, и ионами кальция. Каждая из четырех субъединиц, обозначаемых α, β, γ и δ, представлена в комплексе четырьмя копиями. γ-субъединица осуществляет катализ; чувствительность фермента к Са2+ определяется в основном δ-субъединицей – кальмодулином; субъединицы же α и β – мишени для цАМФ-зависимой регуляции: обе они фосфорилируются протеинкиназой А.
Тот же Са2+-сигнал, который инициирует мышечное сокращение, обеспечивает и достаточный для этого источник энергии в виде глюкозы. Массированный выброс в цитозоль ионов кальция из саркоплазматического ретикулума, вызывающий сокращение миофибрилл, одновременно повышает активность киназы фосфорилазы, изменяя конформацию ее δ-субъединицы, и в результате скорость расщепления гликогена за несколько секунд увеличивается в сотни раз. Кроме того, выброс Са2+ активирует две Са-киназы, которые фосфорилируют и ингибируют гликогенсинтазу, прекращая синтез гликогена. А цепь реакций фосфорилирования, запускаемая в мышечных клетках адреналином (рассмотрена выше), заранее приспосабливает их метаболизм к повышенным энергозатратам; так, например, фосфорилирование киназы фосфорилазы протеинкиназой А делает ее более чувствительной к Са2+ – для активации теперь требуется меньшее число кальция, связанных с кальмодулином.
Фосфоинозитидный путь передачи сигнала
На протяжении ряда лет в качестве вторых посредников были известны только цАМФ, цГМФ и ионы Са2+ . Между тем к концу 1970–х годов появились сведения еще об одной системе, связывающей внешние сигналы с внутриклеточными процессами. На первый взгляд эта система сильно отличается от ставшей уже классической аденилатциклазной системы, поскольку в ней участвуют сложные молекулы липидов – компонентов самой клеточной мембраны. Однако при более внимательном рассмотрении становится очевидным, что система липидных посредников имеет ряд общих черт с аденилатциклазной системой. В обоих случаях в мембране присутствуют рецептор, G–белок и фермент, усиливающий сигнал. Последний превращает фосфорилированный предшественник во вторые посредники, которые активируют внутриклеточные регуляторы – главным образом протеинкиназы, а те в свою очередь активируют специфические для данной ткани и для данных протеинкиназ молекулы–эффекторы. По этому механизму, который получил название кальций-фосфолипидный механизм, действуют вазопрессин (через V1-рецепторы), адреналин (через α1-адренорецепторы), ангиотензин II.
Примечательная особенность данного механизма состоит в том, что фосфолипидный компонент мембраны сам служит фосфорилированным предшественником для образования молекул–посредников. Этот предшественник, находящийся в основном во внутренней половине липидного бислоя, – фосфатидилинозитол–4,5–бисфосфат (ФИФ2) – представляет собой фосфолипид, содержащий три фосфатные группы. Неожиданным оказалось и то, что при гидролизе этого предшественника освобождается не один, а два вторых посредника – диацилглицерол (ДАГ) и инозитолтрифосфат (ИФз).
Механизм действия. Принцип работы этого механизма совпадает с принципом работы цАМФ, но вместо аденилатциклазы мишеневым ферментом для α-субъединицы служит фосфолипаза С. Фосфолипаза С расщепляет мембранный фосфолипид фосфатидилинозитолдифосфат до вторичных мессенджеров инозитолтрифосфата (ИФ3) и диацилглицерола (ДАГ).

Фосфолипаза С.
Фосфолипаза C — фосфолипаза, гидролизующая фосфодиэфирную связь между глицериновым остатком фосфолипида и полярной фосфатной группой. Относится к фосфодиэстеразам. Фосфолипаза С является ключевым ферментом метаболизма фосфатидилинозитола и липидных сигнальных путей.

Инозитолтрифосфат – небольшая водорастворимая молекула, которая освобождает Са2+ из их хранилищ внутри клетки. Очевидно, связывание ИФ3 с рецептором на цитоплазматической поверхности внутриклеточной органеллы открывает кальциевые каналы в ее мембране. Два механизма делают выброс кальция кратковременным:
1. ионы кальция, поступающие в цитозоль, быстро откачиваются оттуда, в основном за пределы клетки.
2. Часть ИФ3 быстро дефосфорилируется специальной фосфатазой. Однако дефосфорилируется не весь ИФ3: часть его фосфорилируется до инозитол-1,3,4,4-тетракисфосфата (ИФ4), при участии которого в клетке, возможно, развиваются более медленные и продолжительные реакции.
Высвобожденные кальций влияет на активность протеинкиназы С, к которой вернемся чуть позже, или, связываясь с кальмодулином, действует на Са2+/кальмодулин-зависимые протеинкиназы (Са-киназы), о которых говорилось выше.
Диацилглицерол. В то время как ИФ3, образующийся при гидролизе ФИФ2, повышает концентрацию Са2+ в цитозоле, другой продукт расщепления – диацилглицерол – производит совершенно другие эффекты. Молекулы ДАГ остаются во внутреннем листке липидного бислоя, в котором они могут перемещаться путем латеральной диффузии. У него есть две потенциально сигнальные роли: он может распадаться дальше с образованием арахидоновой кислоты, необходимой для синтеза простагландинов и родственных им медиаторов липидной природы, или, что важнее, способен активировать специфическую протеинкиназу, которая затем фосфорилирует ряд белков с различными функциями в клетке-мишени.
Протеинкиназа С. Фермент, активируемый ДАГ, называется протеинкиназой С, так как его активность зависит от Са2+. ДАГ вместе с фосфолипидом внутреннего слоя плазматической мембраны фосфатидилсерином присоединяются к протеинкиназе С, повышая ее сродство к кальцию настолько, что она становится активной уже при низких концентрациях ионов в цитозоле. Во многих клетках, однако, протеинкиназа С в норме активируется совместным воздействием диацилглицерола и ионов Ca2+, концентрация которых в цитозоле повышается под влиянием ИФ3. Активация протеинкиназы С кратковременна, так как через несколько секунд диацилглицерол фосфорилируется до фосфатидной кислоты или расщепляется с высвобождением арахидоновой кислоты.
Протеинкиназа С переносит концевую фосфатную группу с АТФ на специфические сериновые и треониновые остатки белков-мишеней, которые в разных клетках различны. Например, во многих животных клетках протеинкиназа С фосфорилирует и тем самым активирует Na+/H+-обменник плазматической мембраны, контролирующий внутриклеточный pH, а повышение pH в клетке может способствовать пролиферации.
Множественные эффекты фосфоинозитидного пути.
| Внешний стимул | Ткань | Реакция клеток |
| Вазопрессин | Печень | Расщепление гликогена |
| Ацетилхолин | Поджелудочная железа | Секреция амилазы |
| Гладкая мускулатура | Сокращение | |
| Ооциты (шпорцевой лягушки) | Повышение проницаемости для хлорид–иона | |
| Бета–клетки поджелудочной железы | Секреция инсулина | |
| Серотонин | Слюнная железа (у мясной мухи) | Секреция жидкости |
| Тромбин | Тромбоциты | Агрегация тромбоцитов |
| Антиген | Лимфоциты | Синтез ДНК |
| Тучные клетки | Секреция гистамина | |
| Факторы роста | Фибробласты | Синтез ДНК |
| Свет | Фоторецепторы | Преобразование стимула в нервный сигнал |
| Сперматозоиды | Яйца морского ежа | Оплодотворение |
| Тиреолиберин | Аденогипофиз | Секреция пролактина |
Циклический ГМФ
цАМФ – не единственный циклический нуклеотид, используемый для внутриклеточной сигнализации. Большинство животных клеток содержит также циклический гуанозинмонофосфат, хотя его концентрация в клетках примерно в 100 раз меньше концентрации цАМФ. цГМФ изучен не так хорошо как цАМФ и очень многое в его действии до сих пор остается загадкой. К примеру, известно, что цГМФ служит активатором специфический протеинкиназы (протеинкиназа G), фосфорилирующей в клетке определенные белки, однако роль цАМФ в передаче сигналов от рецепторов клеточной поверхности, за несколькими исключениями, не ясна. Протеинкиназа G состоит из двух субъединиц – каталитического и регуляторного доменов, сходных с таковыми в протеинкиназе А, но эти протеинкиназы узнают разные последовательности белков, оказывая тем самым разные биологические эффекты.
Чаще всего цГМФ вызывает эффекты противоположные эффектам цАМФ. Например, в сердечной мышце адреналин стимулирует образование цАМФ, тогда как ацетилхолин стимулирует образование цГМФ. Ацетилхолин и адреналин оказывают противоположное влияние на частоту и силу сердечных сокращений – первый их уменьшает, а второй увеличивает. Это различие позволяет предположить, что цАМФ и цГМФ дают противоположные внутриклеточные эффекты. Активация β-адренэргических рецепторов в сердечной мышце, головном мозгу, гладкой мускулатуре и лимфоцитах ведет одновременно к повышению концентрации цАМФ и снижению концентрации цГМФ. Напротив, стимуляция в этих тканях мускариновых рецепторов ацетилхолином приводит к уменьшению количества цАМФ и увеличению количества цГМФ.
Однако к настоящему времени получено много данных, что цГМФ принадлежит самостоятельная роль в регуляции функций клеток. В частности, в почках и кишечнике он контролирует ионный транспорт и обмен воды, в сердечной мышце служит сигналом релаксации и другие.
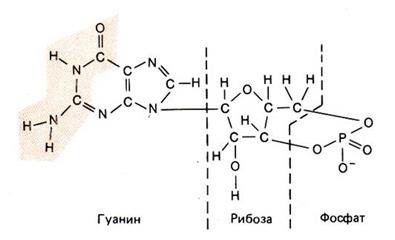
цГМФ образуется из ГТФ (аналога АТФ) под действием фермента гуанилатциклазы, существующей в двух формах – цитоплазматической (находится в цитоплазме) и мембранной (связана с мембраной). Гуанилатциклаза в отличие от аденилатциклазы обычно является растворимым ферментом и не сопряжена явным образом с поверхностными рецепторами, хотя уровень цГМФ часто повышается при активации инозитолфосфолипидного пути, а точнее образование цГМФ сильно зависит от концентрации ионов Са2+ (есть в схемах выше). Мембраносвязанные формы гуанилатциклазы состоят из трех участков: рецепторного, локализованного на внешней поверхности мембраны; внутримембранного домена и каталитического компонента, одинакового в разных форм фермента. Растворимые гуанилатциклазы представляют собой гетеродимер из α- и β-субъединиц. Растворимая гуанилатциклаза активируется также новым внутриклеточным и межклеточным мессенджером – короткоживущей мембранопроницаемой молекулой окиси азота – NO.
Лучше всего сигнальная роль цГМФ выяснена в реакции на свет палочек в сетчатке позвоночных, где цГМФ прямо воздействует на Na+-каналы плазматической мембраны. В отсутствие света молекулы цГМФ связаны с натриевыми каналами и удерживают их в открытом состоянии. Свет активирует в мембранных дисках палочек родопсин; активированный родопсин взаимодействует с G-белком трансдуцином, так же активируя его. α-субъединица трансдуцина в свою очередь активирует цГМФ-фосфодиэстеразу, которая гидролизирует цГМФ, резко снижая его концентрацию в цитозоле, и молекулы цГМФ, связанные с натриевыми каналами, отделяются от них, позволяя им закрыться. Таким образом, световой сигнал преобразуется в электрический независимо от протеинкиназы.
Заключение
Одним из самых загадочных свойств процессов внутриклеточной сигнализации является специфичность сигнализации, если учесть, что более 30 гормонов используют универсальные вторичные мессенджеры для передачи информации от плазматической мембраны к внутриклеточным эффекторам. До сих пор неясно, каким образом определенные гормоны активируют конкретные протеинкиназы или фосфатазы для определенных внутриклеточных событий. В настоящее время привлекает внимание «гипотеза мишени», предполагающая, что процессы фосфорилирования контролируются частично тем, в какой области клетки локализованы киназы и фосфатазы. Кроме того, в последнее время появились данные о том, что специфичность сигнализации может достигаться компартментализацией сигнальных комплексов в определенных участках мембраны. Участки сборки сигнальных комплексов, включающих в себя рецепторы, G-белки, эффекторы и внутриклеточные мишени для генерируемых вторичных посредников, могут быть специализированные участки плазматической мембраны, называемые кавеолами. Это одна из последних теории, которая сейчас изучается усиленно.
И на самом деле, изучая эту тему для реферата, вначале я был немного обескуражен, потому что думал, что тут особо рассказывать не о чем. Но покопавшись в интернете, взяв книги и статьи в библиотеке университета, я был еще больше удивлен от того количества материала о путях передачи сигнала. Естественно я рассматривал пути, связанные с вторичными посредниками, пропуская арахидоновую кислоту и ее роль во внутриклеточной сигнализации, а еще тирозинкиназные и торизинфосфатазные пути, STAT-белки, рецепторы цитокинов. Мне даже пришлось пропустить абсолютно новый, и пока что очень мало изученный вторичный посредник – NO, удовлетворившись только его упоминанием один раз. Так же можно было более обширно упомянуть, что в большинстве случаев процесс активации находится под контролем не одной, а нескольких систем внутриклеточной сигнализации, так что важным фактором формирования ответа клеток становится взаимосвязь этих систем. И можно посвятить целую книгу о значении вторичных посредников в фармакологии и патологии.
Тема настолько обширна и интересна (я раньше не подозревал, что это настолько интересная тема), что ее не уложить в 20-25 страниц реферата. Поэтому я постарался рассмотреть самые важные, по моему мнению, вещи, связанные с вторичными посредниками, пытаясь отобрать нужную информация и изложить ее так, чтоб выстраивалась у читателя точно такая же картинка работы вторичных посредников, как и у меня. Так же я использовал схемы, которые лучше всего, как мне показалось, отображали механизмы процессов.
Список литературы.
1. Зинченко В.П. и Долгачева Л.П. - "Внутриклеточная сигнализация" - http://www.bioscience.ru/CellSign.htm
2. А.Г. Камкин, А.А. Каменский – «Фундаментальная и Клиническая Физиология», раздел 4, стр. 285.
3. Журнал «Цитология», 2000г, том 42, №9 – З.И. Крутецкая, О.Е. Лебедев «Структурно-функциональная организация сигнальных систем в клетках», стр. 844.
4. Б. Албертс, Д. Брей, Дж. Льюис, М. Рэфф, К. Робертс, Дж. Уотсон – «Молекулярная биология клетки», раздел 12, стр. 338.
5. Р. Эккерт, Д. Рэндалл – «Физиология животных», раздел 9.
6. А.Д. Ноздрачев, Ю.И. Баженов, И.А. Баранникова и др. – «Общий курс физиологии человека и животных».
7. Б.Ф. Коровкин, Т.Т. Березов – «Биологическая химия», стр. 289.
8. База знаний по биологии человека - http://humbio.ru/humbio/genexp/0006b1d4.htm
9. Как внешние сигналы передаются внутрь клетки (Филиппов П. П., 1998), статья - http://www.pereplet.ru/obrazovanie/stsoros/507.html
10. Биохимия для студента - http://www.biokhimija.ru/lekcii-po-biohimii/25-gormony.html
11. К.В. Судаков – «Нормальная физиология», стр.218.
12. Р. Марри, Д. Греннер – «Биохимия человека», 1993г.
13. Я. Кольман – «Наглядная биохимия», http://www.chem.msu.su/rus/teaching/kolman/
14. Kaplan lecture notes for step 1, 2008 - 2009г.
15. Шмидт Р., Тевс Г. – «Физиология человека».
Дата добавления: 2015-08-17; просмотров: 376 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Три механизма передачи сигнала в зависимости от вида мембранных рецепторов | | | ПОЛНОЕ ЖИТИЕ СВЯТИТЕЛЯ ГРИГОРИЯ, ЕПИСКОПА ОМИРИТСКОГО |