
Читайте также:
|
The fourth and final quantum number is the spin quantum number, designated as:
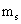
This number describes the direction the electron is spinning in a magnetic field — either clockwise or counterclockwise. Only two values are allowed: +1/2 or –1/2. For each subshell, there can be only two electrons, one with a spin of +1/2 and another with a spin of –1/2.
Строение атома: квантово-механическая модель
Две модели атомной структуры используются в настоящее время: Бор модели и квантовыемеханические модели. Квантово-механическая модель основана на математику. Хотя это более трудно понять, чем модели Бора, она может быть использована для объяснения наблюдений на сложных атомов.
Модель полезна, так как помогает понять, что наблюдается в природе. Это не редкость, чтобы иметь больше, чем одну модель представлять и помочь людям понять конкретную тему.
Квантово-механическая модель основана на квантовой теории, которая говорит, что вопрос также имеет свойства, связанные с волнами. Согласно квантовой теории, невозможно знать точные координаты и импульса электрона в то же время. Это известно как принцип неопределенности.
Квантово-механическая модель атома использует сложные формы орбиталей (иногда называемые электронные облака), объемы пространства, в котором существует вероятность, что электрон. Таким образом, эта модель основана на вероятности, а не определенности.
Четыре номера, которые называются квантовыми числами, были введены для описания характеристик электронов и их орбит:
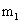
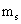
Главным квантовым числом
Главным квантовым числом описывает среднее расстояние орбитального из ядра - и энергии электрона в атоме. Он может иметь положительное целое число (целое число) значений: 1, 2, 3, 4, и так далее. Чем больше значение п, тем больше энергии и больших орбитальных. Химики иногда называем орбиталей электронных оболочек.
Квантовое число углового момента
Квантовое число углового момента L описывает форму орбитали, и форма ограничена главным квантовым числом п: квантовое число углового момента L может иметь положительные целые значения от 0 до N-1. Например, если значение N равно 3, три значения, разрешенные для л: 0, 1 и 2.
Значение л определяет форму орбитали, и значение п определяет размер.
Орбиталей, которые имеют одинаковое значение п, но разными значениями L называются подоболочкам. Эти подоболочках приведены различные буквы, чтобы помочь химикам отличить их друг от друга. В следующей таблице приведены буквы, соответствующие различным значениям л.
| Буквенные обозначения Подоболочки | |
| Значение L (подоболочке) | Письмо |
| с | |
| P | |
| ре | |
| фа | |
| грамм |
Когда химики описывают одного конкретного подоболочке в атоме, они могут использовать как значение N и подоболочка письмо - 2р, 3d, и так далее. Обычно подоболочке значение 4 является крупнейшим необходимых для описания конкретного подоболочке. Если химиков когда-нибудь понадобится большее значение, они могут создать подоболочке цифр и букв.

На следующем рисунке показаны формы S, P, D и орбиталей.
Как показано в верхнем ряду на рисунке (а), есть два орбиталей с - по одному на энергетическом уровне 1 (1S), а другой для энергии уровня 2 (2S). Х-орбиталей имеют сферическую форму с ядром в центре. Обратите внимание, что 2s-орбиталь имеет больший диаметр, чем 1s-орбиталь. В больших атомов, 1s-орбитали расположен внутри 2S, как 2р расположен внутри 3p.
Второй ряд на рисунке (б) показаны формы р-орбитали, а последние два ряда (С) показаны формы D орбиталей. Обратите внимание, что формы получают все более сложными.
Магнитное квантовое число
Магнитное квантовое число обозначается как:
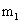
Это число описывает, как различные орбитали ориентируются в пространстве. Значение этого количество зависит от величины л. Допустимые значения являются целыми числами от - L от 0 до + л. Например, если значение L = 1 (р-орбиталь), вы можете написать три значения этого числа: -1, 0, +1 и. Это означает, что существует три различных подоболочкам P для конкретной орбитальной. Подоболочки имеют такую же энергию, но различной ориентации в пространстве.
Второй ряд (б) рисунке показано, как р-орбитали ориентированы в пространстве. Обратите внимание, что трех р-орбиталей соответствуют магнитным квантовым числом значения -1, 0 и +1, ориентированных вдоль х, у, и Z осей.
Спинового квантового числа
Четвертый и последний квантовое число спинового квантового числа, обозначенный как:
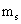
Это число описывает направление электрона вращается в магнитном поле - либо по часовой стрелке или против часовой стрелки. Только два значения допускаются: +1 / 2 или -1 / 2. Для каждого подоболочке, может быть только два электрона, один со спином +1 / 2 и другое со спином -1 / 2.
Дата добавления: 2015-08-03; просмотров: 37 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| The magnetic quantum number | | | Isotopes |