
Читайте также:
|
При изучении коагуляции золей возникло много теорий, с помощью которых пытались на качественном и количественном уровнях объяснить все наблюдаемые закономерности.
Так в 1908 г. Г. Фрейндлих сформулировал основные положения адсорбционной теории коагуляции, наблюдаемой при внесении в золь электролитов. Согласно этой теории агрегация коллоидных частиц происходит вследствие адсорбции противоионов поверхностью гранулы и уменьшения величины ее дзетта-потенциала. Однако эта теория имела ограниченное применение, т.к. учитывала только влияние электролитов и не могла объяснить те факты, в которых слипание частиц было связано лишь с изменениями в диффузном слое мицеллы, а величина ζ-потенциала гранулы оставалась неизменной.
Позже Г. Мюллером была разработана электростатистическая теория, которая уже исходила из того, что введение электролита в золь не изменяет общего заряда в двойном электрическом слое частицы, а вызывает сжатие (уменьшение размеров) диффузного слоя. Это и приводит к уменьшению устойчивости системы.
Адсорбционная, электростатическая и ряд других теорий коагуляции не могли объяснить всех наблюдаемых экспериментальных фактов, но они сыграли положительную роль в развитии представлений об устойчивости коллоидных систем. Их важнейшие положения вошли составной частью в современную теорию устойчивости, которая хорошо согласуется с поведением типичных лиофобных дисперсных систем.
Она была разработана в 1937-1943 гг. независимо друг от друга Б.В. Дерягиным и Л.Д. Ландау в СССР и Э. Фервеем и Дж. Т. Овербеком в Голландии. В соответствии с первыми буквами фамилий авторов теория носит название ДЛФО.
Согласно данной теории коллоидные частицы в растворе вследствие броуновского движения могут беспрепятственно сближаться друг с другом пока не соприкоснутся своими жидкими диффузными оболочками или слоями. При этом между ними не возникает никаких сил взаимодействия. Для дальнейшего сближения частицы должны деформировать свои диффузные оболочки, чтобы произошло их взаимное перекрывание (или проникновение друг в друга). Но жидкости плохо сжимаются и в ответ на деформацию с их стороны появляются так называемые силы расклинивающего давления, препятствующие осуществлению данного процесса. Причем чем больше размеры диффузного слоя, тем значительнее силы расклинивающего давления.
 Борис Владимирович Дерягин (1902 – 1994) — русский физикохимик, профессор (1935), член-корреспондент АН СССР (1946), академик РАН (1992). Создал учение о поверхностных силах и их влиянии на расклинивающее давление и свойства тонких жидких пленок. Премия им. М. В. Ломоносова АН СССР (1958), Государственная премия СССР (1991). С 1936 по 1994 год возглавлял созданные им лабораторию и Отдел сорбционных процессов Института физической химии АН СССР. Много лет был главным редактором журнала «Коллоидной химии». В 1962—1973 гг. предполагал существование особой разновидности воды — поливоды. Потом сам себя опроверг, обнаружив критическое влияние примесей — силикатов.
Борис Владимирович Дерягин (1902 – 1994) — русский физикохимик, профессор (1935), член-корреспондент АН СССР (1946), академик РАН (1992). Создал учение о поверхностных силах и их влиянии на расклинивающее давление и свойства тонких жидких пленок. Премия им. М. В. Ломоносова АН СССР (1958), Государственная премия СССР (1991). С 1936 по 1994 год возглавлял созданные им лабораторию и Отдел сорбционных процессов Института физической химии АН СССР. Много лет был главным редактором журнала «Коллоидной химии». В 1962—1973 гг. предполагал существование особой разновидности воды — поливоды. Потом сам себя опроверг, обнаружив критическое влияние примесей — силикатов.
Если столкнувшиеся частицы обладают достаточным запасом кинетической энергии для преодоления действия этих сил, то их диффузные слои перекроются, но в этот момент между ними и гранулами возникнут электростатические силы расталкивания (т.к. они имеют заряды одинакового знака) (рис. 68).
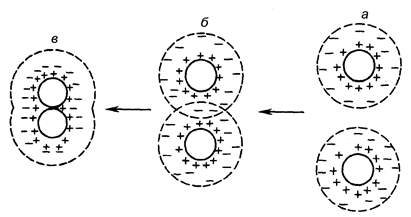
Рис. 68. Схема взаимодействия коллоидных частиц: а – агрегатиано устойчивая система; б – перекрывание диффузных слоев; в – коагуляция
 Лев Дави́дович Ланда́у (1908 — 1968), часто именуемый Дау — советский физик, академик АН СССР (избран в 1946). Лауреат Нобелевской, Ленинской и трёх Сталинских премий, Герой Социалистического Труда. Член академий наук Дании, Нидерландов, США, Франции, Лондонского физического общества и Лондонского королевского общества. Инициатор создания и соавтор Курса теоретической физики, выдержавшего многократные издания и переведённого на многие языки. Именем Ландау названа золотая медаль, вручающаяся с 1998 г. Отделением ядерной физики РАН.
Лев Дави́дович Ланда́у (1908 — 1968), часто именуемый Дау — советский физик, академик АН СССР (избран в 1946). Лауреат Нобелевской, Ленинской и трёх Сталинских премий, Герой Социалистического Труда. Член академий наук Дании, Нидерландов, США, Франции, Лондонского физического общества и Лондонского королевского общества. Инициатор создания и соавтор Курса теоретической физики, выдержавшего многократные издания и переведённого на многие языки. Именем Ландау названа золотая медаль, вручающаяся с 1998 г. Отделением ядерной физики РАН.
Чем больше ζ-потенциал гранул, тем сильнее взаимное отталкивание частиц.
В случае преодоления этих сил и сближения гранул на расстояние ≈ 10–7 см и меньше (т.е. на расстояние равное или меньшее размерам одной молекулы дисперсионной среды) между ними возникают так называемые Ван-дер-Ваальсовые силы притяжения, имеющие физическую природу. Они и вызывают сцепление (соединение) коллоидных частиц друг с другом.
Обычно в стабилизированном гидрофобном золе лишь небольшая доля так называемых активных частиц обладает достаточным запасом кинетической энергии, чтобы при соударении преодолеть действие всех вышеперечисленных сил. Поэтому такие коллоидные системы сохраняют свою устойчивость более или менее длительное время (в зависимости от степени своей стабилизации). При повышении температуры скорость и интенсивность броуновского движения возрастают. Это приводит к увеличению запаса кинетической энергии коллоидных частиц. Все большее их число переходит в разряд активных. В результате при соударении они чаще начнут слипаться друг с другом, а агрегативная устойчивость золя будет уменьшаться.
Любые другие внешние воздействия, оказываемые на золь и приводящие к уменьшению размеров диффузных слоев и величины ζ-потенциала, также будут способствовать протеканию процессов коагуляции.
Наименьшей устойчивостью обладают коллоидные системы, частички дисперсной фазы в которых не имеют двойного электрического слоя и защитной оболочки из молекул растворителя.
В данном случае электростатические силы расталкивания и силы расклинивающего давления между частицами не возникают и поэтому практически любое соударение их друг с другом приведет к взаимному сцеплению.
Физическая теория коагуляции ДЛФО обладает большим математическим аппаратом и позволяет осуществлять различные количественные расчеты, которые хорошо согласуются с наблюдаемыми экспериментальными фактами.
Дата добавления: 2015-08-02; просмотров: 213 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Установлена прямая зависимость между величиной дзетта-потенциала гранулы, толщиной гидратной (сольватной) оболочки частицы и агрегативной устойчивостью золя. | | | Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди |