
Читайте также:
|
Влияние температуры на селективность связано с типом модели реактора. Т. к. реакторы смешения работают в изотермическом режиме, а реактор вытеснения имеют либо адиабатический режим, либо политермический..
Влияние температуры выражается уравнением Аррениуса
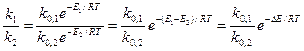 ,
,
где k0 – предэкспоненциальный множитель;
Е1, Е2 – энергии активации основной и побочной реакции.
Влияние температуры на селективность зависит от соотношения энергий активации параллельных реакций. Если энергия активации основной реакции выше Е1 > Е2, то при низких температурах скорость побочной реакции выше, чем основной. Поэтому при низкой температуре селективность мала. Повышение температуры приводит к росту скорости и увеличению селективности. Если же Е1 < Е2, то повышение температуры нецелесообразно.
В зависимости от соотношения Е1 и Е2 влияние температуры на селективность различно. Изменить это соотношение можно проведением процесса в присутствии селективного катализатора, который будет снижать энергию активации целевой реакции и мы будем получать высокий выход при низкой температуре.
 Для РИС – Н величины Х, ФR и φ во всем объеме постоянны и поэтому связь между этими параметрами можно выразить уравнением
Для РИС – Н величины Х, ФR и φ во всем объеме постоянны и поэтому связь между этими параметрами можно выразить уравнением
Ф = φ χ
 Для РИВ эти же величины меняются по длине реактора, поэтому для него применяют выражение ФR =
Для РИВ эти же величины меняются по длине реактора, поэтому для него применяют выражение ФR = 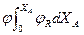
Графическое изображение этих уравнений позволяет установить тип реактора, обеспечивающий максимальный выход целевого продукта.
Для параллельных реакций 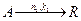

Селективность можно выразить уравнением
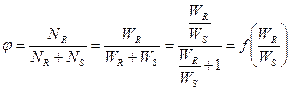 ,
,
т.е. является функцией отношения WR/WS.
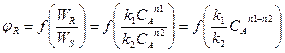
Из уравнения следует, что по постоянной температуре в каждом конкретном случае, когда известен порядок основной и побочной реакции, селективность зависит только от концентрации СА, так как отношение констант скорости реакции k1/k2 в этих условиях постоянная. Поэтому в зависимости от разности n1 – n2 влияние СА на φR может быть либо положительным, либо отрицательным.
1) Если порядок основной реакции выше порядка побочной реакции, т.е. n1 > n2, то n1 – n2 = а.
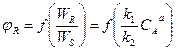
Т. е. при увеличении концентрации исходного вещества СА селективность возрастает. Следовательно, для достижения высокой селективности выгодно поддерживать высокую концентрацию исходного вещества, т.е. выгодно применять РИВ или К – РИС, т.к. в этих реакторах средняя концентрация реагента СА выше, чем в РИС – Н.
2) Если порядок основной реакции ниже порядка побочной реакции, т.е. n1 < n2 то n1 – n2 = -а.
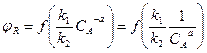
Из этого уравнения видно, что при увеличении СА селективность снижается. При этом выгодно применять РИС – Н, т. к. концентрация исходного вещества в нем ниже, чем в РИВ. В данном случае изменение величины СА оказывает на эти параметры противоположное действие (интенсивность и селективность). При снижении СА интенсивность уменьшается, а селективность возрастает. Что лучше – можно решить технико – экономическим анализом.
Если n1 = n2, то n1 – n2 = 0
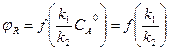 ,
,
т.е. селективность не зависит от концентрации исходного реагента и тип реактора не влияет на селективность. В этом случае изменяют температуру или применяют катализатор селективного действия, который может изменить соотношение k1/k2.
Дата добавления: 2015-08-10; просмотров: 56 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Селективность, выход, степень превращения | | | Последовательные реакции |