
Читайте также:
|
В некоторой типичной химической реакции молекула типа А. может соединиться с молекулой типа В, в результате чего возникнет одна молекула типа С и одна молекула типа D. Символически этот процесс можно записать в виде
 , (1а),
, (1а),
где k - константа скорости в общем случае зависящая от температуры и давления. Вещества А и В, реагенты, соединяются во время реакции и их концентрация уменьшается, а вещества С и D, продукты, образуются в результате реакции. Опытным путем установлено, что даже после длительного ожидания в изолированной системе реагенты А и В не исчезают полностью, а устанавливается состояние химического равновесия с некоторыми  конечными значениями концентраций всех участвующих в реакции веществ. Величина
конечными значениями концентраций всех участвующих в реакции веществ. Величина 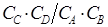 , устанавливающаяся по истечении достаточно большого времени, называется константой равновесия. При равновесии реагенты не исчезают полностью потому, что существует обратноe превращение
, устанавливающаяся по истечении достаточно большого времени, называется константой равновесия. При равновесии реагенты не исчезают полностью потому, что существует обратноe превращение  (1б), скорость которого K в состоянии равновесия (детального равновесия) равна скорости k. При этом предполагается, что значения давления, температуры и других физических параметров постоянны.
(1б), скорость которого K в состоянии равновесия (детального равновесия) равна скорости k. При этом предполагается, что значения давления, температуры и других физических параметров постоянны.

Рис.1. Экспериментальная реализация открытой химической системы
Отклонение от равновесия в рассматриваемой химической cистеме можно добиться за счет потока массы из окружающей среды (или наоборот). При этом система становится открытой. Это можно реализовать, например, путем пропускания через реакционный объем смеси, обогащенной компонентами A и B, с одновременным удалением части смеси реагента и продукта (рис.1). Комбинируя определенным образом скорости притока и оттока вещества, можно создать такие условия, когда в системе отношение уже не определяется константой равновесия.устанавливаются постоянные концентрации A, B, C, D, но их Математически такое состояние соответствует равенству нулю скоростей изменения концентраций c:

В такой ситуации говорят о стационарном неравновесном состоянии. При наличии возмущения этого состояния, например, временного увеличения скорости прямой реакции по сравнению с обратной, в системе может не произойти восстановления, как это было бы около состояния детального равновесия. Например, при автокатализе присутствие продукта может увеличивать скорость его собственного производства. Так в любом процессе горения это происходит благодаря присутствию свободных радикалов - чрезвычайно активных молекул с неспаренными электронами, которые, реагируя с другими молекулами, приводят к дальнейшему увеличению количества свободных радикалов и тем самым к самоускоряющемуся процессу. Другим примером является самовоспроизведение - одно из наиболее характерных свойств жизни. В своей основе оно является результатом некоторого автокаталитического цикла, в котором репликация генетического материала осуществляется благодаря участию специфических белков. В свою очередь эти белки синтезируются благодаря инструкциям, содержащимся в генетическом материале.
Дата добавления: 2015-08-10; просмотров: 43 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Автоволны и структуры в химических системах | | | Колебательные химические реакции. |