
Читайте также:
|
Если реакция
а А + b В = е Е + r R
протекает самопроизвольно при постоянных Р и Т и участвующие в ней вещества являются идеальными газами, то изменение энергии Гиббса будет равно:
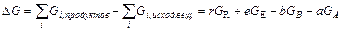 ,
,
где Gi – мольные энергии Гиббса компонентов реакции. Поскольку компоненты реакции являются идеальными газами, то для каждого из них величина энергии Гиббса равна:

Подставляя, получаем:
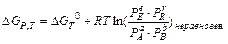
Полученное уравнение называется уравнением изотермы химической реакции (изотермой Вант Гоффа) при постоянных Р, Т. Уравнение изотермы химической реакции при V, T = const можно записать в виде:

При химическом равновесии D GP,T = 0 и из уравнения изотермы химической реакции следует:
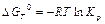 .
.
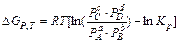 .
.
Если известна константа равновесия химической реакции, легко оценить возможность самопроизвольного течения реакции при иных (неравновесных) парциальных давлениях веществ в системе, определив знак изменения энергии Гиббса. Из уравнения изотермы следует, что если K < 1, то D GT0 > 0 и данная реакция не идет в стандартных условиях. Если D GT0 >> 0, то можно сказать, что D GT > 0 и реакция невозможна при любых разумных составах смеси, изменяя которые можно было бы сделать отрицательным изменение энергии Гиббса данной реакции.
Если при данной температуре стандартное изменение энергии Гиббса имеет большое по абсолютной величине отрицательное значение D GT0 << 0, т.е. K P очень велика, то реакция принципиально осуществима не только в стандартных, но и в других условиях.
Зная величину D GT0, можно сделать вывод о термодинамической устойчивости вещества:
Дата добавления: 2015-08-10; просмотров: 93 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Гетерогенные реакции | | | Влияние температуры на химическое равновесие |