
|
Читайте также: |
Все химические реакции протекают в двух направлениях: в сторону образования продуктов реакции (вправо – прямая реакция) и в сторону превращения продуктов в исходные вещества (влево – обратная реакция). Вследствие обратимости химической реакции не доходят до конца.
Так как скорость реакции прямо пропорциональна концентрации, то с течением времени скорость прямой будет уменьшаться, а скорость обратной расти. Когда обе скорости сравниваются, наступает состояние химического равновесия, когда число молекул, составляющих систему, перестает изменяться и остается постоянным во времени при неизменных внешних условиях. Таким образом, химическим равновесием называется такое состояние обратимой химической реакции, при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Химическое равновесие – это динамическое равновесие, характеризующееся постоянством равновесных концентраций (или парциальных давлений) всех участников реакции при постоянстве внешних условий и минимальным значением энергии Гиббса или энергии Гельмгольца.
Для реакции
СО2 + Н2 = СО + Н2О
выражение для скорости прямого и обратного процессов имеет вид:
v 1 = k 1[СО2][Н2],
v 2 = k 2[СО][Н2О],
где k 1 и k 2 - константы скорости соответственно прямой и обратной реакции.
Скорости процесса дает суждение лишь о разности этих двух скоростей D v = v 1 – v 2. Для химического равновесия v 1 = v 2.
Константы скорости не зависят от концентрации и при постоянной температуре являются постоянными. Поэтому их отношение есть некая постоянная величина, называемая константой химического равновесия:
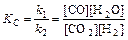 .
.
В общем виде, для реакции
а А + b В = е Е + r R
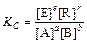
где [A], [B], [E], [R] – равновесные концентрации участников реакции.
Это уравнение выражает закон действующих масс: отношение произведения равновесных активностей (концентраций) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к такому же произведению активностей (концентраций) исходных веществ при данной температуре есть величина постоянная, называемая константой химического равновесия.
Константа химического равновесия – это характеристика химического равновесия, отражающая взаимосвязь между равновесными концентрациями (или парциальными давлениями) веществ, участвующих в химической реакции.
Константы равновесия зависят от природы реагирующих веществ, температуры, и не зависят от концентрации, активности, давления и фугитивности.
Как было сказано выше, при наступлении химического равновесия число молекул веществ, составляющих химическую систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях. При изменении внешних условий равновесие сдвигается в сторону исходных веществ (влево) или в сторону продуктов реакции (вправо) и возвращается к исходному состоянию, если внешние условия приобретают первоначальное значение. Бесконечно малое изменение внешних условий влечет за собой также бесконечно малое изменение состояния равновесия. Таким образом, химические реакции протекают как термодинамические равновесные процессы, т.е. к ним можно применять общие условия термодинамического равновесия. Химическая термодинамика позволяет предсказать концентрации реагентов в смеси и влияние на них изменения внешних условий и предвидеть максимальный выход полезного продукта, что имеет большое практическое значение.
Химическую реакцию можно рассматривать как добавление в систему продуктов реакции и удаление исходных веществ. Закрытую систему, в которой протекают химические превращения, в целом можно рассматривать как совокупность открытых систем, для которых фундаментальное уравнение термодинамики имеет следующий вид (в зависимости от того, какая функция выбрана в качестве термодинамического потенциала):
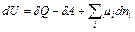 ,
,
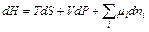 ,
,
 ,
,
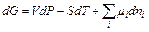 ,
,
где m I – химический потенциал i -го компонента, выражаемый как
 .
.
Величина 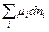 представляет собой изменение термодинамического потенциала в результате изменения количества молей dn всех участников химической реакции.
представляет собой изменение термодинамического потенциала в результате изменения количества молей dn всех участников химической реакции.
Химический потенциал показывает вклад одного моля данного компонента в величину термодинамического потенциала системы. Так как большинство реакций протекает в изобарно-изотермических условиях, то наиболее часто используется выражение:
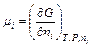 .
.
Соответственно, при постоянстве температуры и давления справедливо равенство:
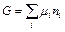 ,
,
где G – общая энергия Гиббса системы.
Общим условием химического равновесия является равенство химических потенциалов продуктов и исходных веществ:
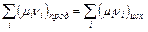 или
или  .
.
Дата добавления: 2015-08-10; просмотров: 47 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ТЕОРЕТИЧЕСКИЕ ОСНОВЫ | | | Константа химического равновесия |