
Читайте также:
|
Рассмотрим подробнее различные способы выражения константы химического равновесия. В разделе 1.1 было показано, что константа равновесия может быть выражена через равновесные концентрации веществ. Кроме этого, константа равновесия может быть выражена следующим образом:
через равновесные парциальные давления
 ,
,
через мольные доли
 ,
,
через моляльности
 .
.
Константы равновесия K C (выражаемая через равновесные концентрации) и K P (выражаемая через равновесные парциальные давления) безразмерны только для реакций, идущих без изменения числа молей газообразных участников. В остальных случаях K P имеет размерность давления, а K C – размерность концентрации в степенях Dn, где Dn = r + e – a – b (изменение числа молей реагирующих газов в течение реакции).
В неидеальных (реальных) системах вместо концентраций компонентов используют активности, вместо парциальных давлений – фугитивности. Константы равновесия, выраженные через активности и фугитивности компонентов, имеют вид:
 ,
,
где аi – равновесные активности компонентов,
 ,
,
где  – равновесные фугитивности компонентов.
– равновесные фугитивности компонентов.
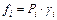 ,
,
где g i – коэффициент фугитивности.
Парциальное давление компонента системы можно выразить следующим образом:
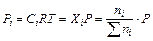 ,
,
где Р – общее давление,  – общее число молей всех компонентов.
– общее число молей всех компонентов.
Связь между некоторыми константами имеет вид:
 .
.
Константа равновесия KХ для реакции в газовой фазе, в отличие от констант KP и KC, зависит от общего давления; если реакция в газовой фазе протекает без изменения числа молей (то есть Dn = 0), то справедливо соотношение:
 .
.
Кроме того, для растворов имеют место соотношения:
 ,
,
 ,
,
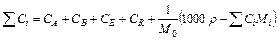 ,
,
где Ci – молярная концентрация i -го компонента (растворенного вещества), M 0 – молярная масса растворителя, r – плотность раствора (г/мл), Mi – молярная масса i -го компонента (растворенного вещества).
Связь между K X и K m имеет вид:
 .
.
Следует помнить, что вид выражения для константы равновесия и ее числовое значение зависят от того, в каком направлении и для каких количеств веществ написано стехиометрическое уравнение реакции. Например, для реакции взаимодействия водорода и азота с образованием аммиака
3H2 + N2 = 2NH3
константа равновесия имеет вид
 ,
,
а при изменении стехиометрических коэффициентов


константа равновесия приобретает вид:
 .
.
Дата добавления: 2015-08-10; просмотров: 76 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общие понятия и представления | | | Гетерогенные реакции |