
|
Читайте также: |
| 1. | NO2 + H2O g HNO3 + HNO2 |
| 2. | HNO2 g NO + NO2 + H2O |
| 3. | HNO3 g NO2 + O2 + H2O |
| 4. | (NH4)2Cr2O7 g N2 + Cr2O3 + H2O |
| 5. | Na3N g N2 + Na |
| 6. | NH4NO2 g N2 + H2O |
| 7. | Pb(NO3)2 g PbO + NO2 + O2 |
| 8. | KNO3 g KNO2 + O2 |
| 9. | NH4NO3 g N2 + O2 + H2O |
| 10. | Hg(NO3)2 g Hg + NO2 + O2 |
| 11. | KBrO g KBrO3 + KBr |
| 12. | Br2 + KOH g KBrO3 + KBr + H2O |
| 13. | I2 + NaOH g NaIO + NaI |
| 14. | I2 + Ba(OH)2 g Ba(IO3)2 + BaI2 + H2O |
| 15. | K2MnO4 g KMnO4 + MnO2 + KOH |
| 16. | MnO2 + H2SO4 g MnSO4 + O2 + H2O |
| 17. | KMnO4 g K2MnO4 + MnO2 + O2 |
| 18. | Mn2O7 g MnO2 + O2 |
| 19. | Mn(NO3)2 g MnO2 + NO2 |
| 20. | MnO2 g Mn2O3 + O2 |
| 21. | CuI2 g CuI + I2 |
| 22. | Na2SO3 g Na2S + Na2SO4 |
| 23. | P + H2O g H3PO3 + PH3 |
| 24. | H3PO3 g H3PO4 + PH3 |
| 25. | H2O2 g H2O + O2 |
| 26. | HClO g HCl + O2 |
| 27. | KClO3 g KCl + O2 |
| 28. | NaClO g NaClO3 + NaCl |
| 29. | KClO3 g KClO4 + KCl |
| 30. | Cl2 + KOH g KClO + KCl + H2O |
11.5. Пользуясь величинами стандартных окислительно-восстанови-
тельных потенциалов(«Таблицы основных свойств элементов и их соединений», табл.8,9), определите возможность протекания реакций, указанных в разделе 11.4а.
11.6. Вычислите молярные массы эквивалентов окислителя или восстановителя, если в ходе реакций происходят превращения:
01.  16.
16. 
02.  17.
17. 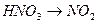
03.  18.
18. 
04.  19.
19. 
05.  20.
20. 
06.  21.
21. 
07.  22.
22. 
08.  23.
23. 
09.  24.
24. 
10.  25.
25. 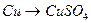
11.  26.
26. 
12.  27.
27. 
13.  28.
28. 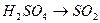
14.  29.
29. 
15.  30.
30. 
Дата добавления: 2015-07-25; просмотров: 58 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| В) нейтральная среда | | | Основы электрохимии |