
Читайте также:
|
01 – Вычислите [H+] в 0,1 М растворе HCN (Кдисс=6,2*10-10). Сколько граммов CN 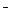 в виде ионов содержится в 0,6 л указанного раствора? Ответ: 7,9*10-6; 1,23*10-4 г.
в виде ионов содержится в 0,6 л указанного раствора? Ответ: 7,9*10-6; 1,23*10-4 г.
02 – При какой молярной концентрации уксусной кислоты в растворе ее степень диссоциации равна 0,01? Кдисс =1,8*10-5. Ответ: 0,178 моль/л.
03 – Вычислите a и [H+] в 0,05 М растворе азотистой кислоты (Кдисс =5*10-4). Ответ: 0,1; 5*10-3.
04 – Во сколько раз [H+] в растворе муравьиной кислоты (К=2,1*10-4) больше, чем в растворе уксусной кислоты (Кдисс =1,8*10-5) той же концентрации? Ответ: в 3,42 раза.
05 – При какой молярной концентрации муравьиной кислоты (Кдисс =2*10-4) 95 % ее находится в недиссоциированном состоянии? Ответ: 0,08 М.
06 – Вычислите [H+] и a в 1 %-ном растворе уксусной кислоты (Кдисс =1,8*105), приняв  =1 г/см3. Ответ: 1,7*10-3; 0,01.
=1 г/см3. Ответ: 1,7*10-3; 0,01.
07 – При каком процентном содержании муравьиной кислоты (НСООН) в растворе ( » 1 г/см3) [H+] = 8,4*10-3 моль/л (Кдисс =2*10-4)? Ответ: 1, 55 %.
» 1 г/см3) [H+] = 8,4*10-3 моль/л (Кдисс =2*10-4)? Ответ: 1, 55 %.
08 – Вычислите a и [H+] в 1 М растворе дихлоруксусной кислоты СHCl2 СООН (Кдисс.=5*10-2). Ответ: 0,2.
09 – Вычислите концентрацию ионов водорода и степень диссоциации 0,2 н раствора СН3СООН, Кдисс=1,8*10-5. Ответ: 1,9*10-3 моль/л; 9,5*10-3.
10 – Вычислите концентрацию гидроксид-ионов и степень диссоциации 1 н раствора NH4OH (Кдисс = 1,8*10-5). Ответ: 4,2*10-3 моль/л; 4,2*10-3.
11 – Вычислите, при какой концентрации (в моль/л) муравьиной кислоты (НСООН) 90 % ее будут находиться в недиссоциированном состоянии? Кдисс = 2,1*10-4. Ответ: 0,02 моль/л.
12 – Вычислите степень диссоциации a и концентрацию водородных ионов в 0,1 М растворе угольной кислоты, Кдисс которой по первой ступени равна 3*10-7. Ответ: 1,7*10-3; 1,7*10-4 моль/л.
13 – Вычислите степень диссоциации и концентрацию водородных ионов в 0,1 М растворе H2S, Кдисс которой по первой ступени равна 9*10-8. Ответ: 9,5*10-3; 9,5*10-4 моль/л.
14 – Вычислите, каково должно быть процентное содержание муравьиной кислоты (НСООН) в растворе (r = 1 г/см3) для того, чтобы концентрация водородных ионов в нем составляла 8*10-3 моль/л? Кдисс = 2,1*10-4. Ответ: 1,4 %.
15 – Вычислите концентрацию водородных ионов и степень диссоциации в 1 %-ном растворе СН3СООН. Плотность раствора равна 1г/мл. Кдисс = 1,8*10-5. Ответ: 1,7*10-3 моль/л; 1 %.
16 – Вычислите, при какой концентрации (моль/л) уксусной кислоты в растворе a ее составит 0,1? Кдисс = 1,8*10-5. Ответ: 0,178 моль/л.
17 – Вычислите a и [H+] в 1 М растворе хлористой кислоты HСlO2 (Кдисс= 1,1*10-2). Ответ: 0,1
18 – Чему равна концентрация ионов водорода Н+ в водном растворе муравьиной кислоты НСООН (Кдисс = 1,8*10-4), если a=0,03? Ответ: 6*10-3моль/л.
19 – Вычислите концентрацию ионов водорода в 0,02 М раствора сернистой кислоты (Кдисс1=1,6*10-2). Диссоциацией кислоты по второй ступени пренебречь. Ответ: 0,014 моль/л.
20 – Вычислите a и [H+] в 1 М растворе трихлоруксусной кислоты CCl3COOH (Кдисс = 2*10-1). Ответ: 0,36; 0,36 М.
21 – В растворе хлорноватистой кислоты (HСlO) концентрации 0,1 моль/л степень ее диссоциации равна 0,08 %. При какой концентрации раствора она увеличится в 2 раза. Ответ: 2,5*10-2 моль/л.
22 – При какой молярной концентрации раствора муравьиной кислоты НСООН (К=1,8*10-4) степень ее диссоциации a равна 6,7 %.? Ответ: 0,04 моль/л.
23 – Вычислите a и [H+] в 1 М растворе иодноватой кислоты HIO3 (Кдисс = 1,6*10-1). Ответ: 0,327.
24 - Найдите молярную концентрацию раствора азотистой кислоты HNO2 (Кдисс = 4*10-4) по значению степени ее диссоциации a=10 %. Ответ: 0,04 моль/л.
25 - Вычислите a и [H+] в 0,3 М растворе HF (Кдисс = 6,8*10-4). Ответ: 4,7*10-2.
26 – Чему равна массовая доля СН3СООН в растворе (r=1г/мл), для которого [H+] = 3,6*10-6 моль/л; a=3,0 %. Ответ: 4,3*10-6; 0,12 %.
27 – Найдите константу диссоциации муравьиной кислоты НСООН по значению степени ее диссоциации a=32 % в растворе концентрации 0,2 моль/л. Ответ: 2*10-4.
28 – Константа диссоциации масляной кислоты С3Н7СООН 1,5*10-5. Вычислите степень ее диссоциации в 0,005 М растворе. Ответ: 0,055.
29 – Найти степень диссоциации хлорноватистой кислоты НОCl в 0,2 н растворе (Кдисс = 5*10-8). Ответ: 5*10-4.
30 – В 0,1 н растворе степень диссоциации уксусной кислоты равна 1,32*10-2. При какой концентрации азотистой кислоты HNO2 ее степень диссоциации будет такой же? Ответ: 2,3 моль/л.
9.4. Определите рН следующих растворов:
01 – 0,01 М хлороводородной кислоты;
02 – 0,1 М циановодородной кислоты (Кдисс = 4,9*10-10);
03 – 0,001 М гидроксида лития;
04 – 0,004 М бромоводородной кислоты;
05 – 0,2 М хлоруксусной кислоты CH2ClCOOH (Кдисс = 1,4*10-3);
06 – 0,02 М гидроксида натрия;
07 – 0,3 М азотной кислоты;
08 – 0,01 М гидроксида аммония (Кдисс = 1,8*10-5);
09 – 0,03 М хлорной кислоты;
10 - 0,004 М гидроксида рубидия;
11 – 0,2 М муравьиной кислоты НСООН (Кдисс = 2,1*10-4);
12 – 0,01 М гидроксида лития;
13 – 0,05 %-ного раствора азотной кислоты (r»1 г/мл);
14 – 0,01 М уксусной кислоты (Кдисс = 1,75*10-5);
15 – 0,005 М азотистой кислоты (Кдисс = 5*10-4);
16 – 0,003 М гидроксида калия;
17 – 0,01 %-ного раствора хлороводородной кислоты (r»1 г/мл);
18 – 0,02 М азотной кислоты;
19 – 0,05 М гидроксида аммония (Кдисс = 1,8*10-5);
20 – 0,025 М иодоводородной кислоты;
21 – 0,005 М гидроксида рубидия;
22 – 0,01 М хлоруксусной кислоты CH2ClCOOH (Кдисс = 1,4*10-3);
23 – 0,03 М азотистой кислоты (Кдисс = 5*10-4);
24 – 0,05 %-ного раствора гидроксида натрия (r» 1 г/мл);
25 – 0,01 М хлорной кислоты;
26 - 0,25 М уксусной кислоты СН3СООН (Кдисс = 1,75*10-5);
27 – 0,1 М муравьиной кислоты НСООН (Кдисс = 2,1*10-4);
28 – 0,15 М хлорноватой кислоты HСlO3;
29 – 0,1 М гидроксида натрия;
30 – 0,02 М бромоводородной кислоты.
Дата добавления: 2015-07-25; просмотров: 244 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| СВОЙСТВА ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ | | | Гетерогенное равновесие |