
|
Читайте также: |
Питання та задачі до контрольних робіт з теми
“Швидкість хімічних реакцій. Хімічна рівновага”
91. Швидкість хімічної реакції  при концентраціях реагуючих речовин
при концентраціях реагуючих речовин 
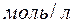 та
та 
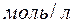 дорівнює 1,2×10-3
дорівнює 1,2×10-3  . Розрахувати значення константи швидкості реакції. Чи однакова розмірність констант для різних реакцій?
. Розрахувати значення константи швидкості реакції. Чи однакова розмірність констант для різних реакцій?
92. При змішуванні газообразних речовин  та
та  перебігає хімічна реакція
перебігає хімічна реакція
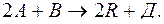 Відомо, що через деякий час після початку реакції концентрація речовин дорівнювала:
Відомо, що через деякий час після початку реакції концентрація речовин дорівнювала: 
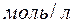 ;
; 
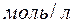 ;
; 
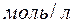 . Розрахувати вихідні концентрації речовин
. Розрахувати вихідні концентрації речовин 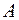 і
і 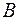 .
.
93. Реакція перебігає згідно з рівнянням  При певній температурі константа швидкості цієї реакції дорівнює 0,16. Вихідні концентрації реагуючих речовин
При певній температурі константа швидкості цієї реакції дорівнює 0,16. Вихідні концентрації реагуючих речовин 

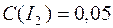
 Розрахувати початкову швидкість та швидкість реакції в момент, коли концентрaція водню зменшується вдвічі.
Розрахувати початкову швидкість та швидкість реакції в момент, коли концентрaція водню зменшується вдвічі.
94. Як зміняться концентрації реагуючих речовин (вихідні концентрації 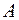 та
та 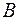 однакові), коли швидкість реакції, що перебігає згідно з рівнянням
однакові), коли швидкість реакції, що перебігає згідно з рівнянням  зменшиться в 100 разів?
зменшиться в 100 разів?
95.Як зміниться швидкість реакції  якщо реакційну суміш вдвічі збагатити киснем при сталому тиску?
якщо реакційну суміш вдвічі збагатити киснем при сталому тиску?
96. Як зміниться швидкість реакції 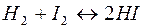 при збільшенні вдвічі: а) тиск у системі; б) об’єм системи (без зміни кількостей речовин); в) концентрацію йоду в системі?
при збільшенні вдвічі: а) тиск у системі; б) об’єм системи (без зміни кількостей речовин); в) концентрацію йоду в системі?
97.У скільки разів слід збільшити тиск газової суміші, щоб швидкість реакції  ) збільшилась у 1000 разів?
) збільшилась у 1000 разів?
98. У скільки разів слід збільшити концентрацію речовини 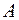 , щоб при зменшенні концентрації речовини
, щоб при зменшенні концентрації речовини 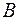 у 4 рази швидкість реакції
у 4 рази швидкість реакції  не змінилась?
не змінилась?
99.Температурний коефіцієнт швидкості реакції дорівнює 3. Як зміниться швидкість цієї реакції при збільшенні температури від 80 до 130°С?
100. На скільки градусів слід збільшити температуру системи, щоб швидкість реакції, яка в ній перебігає, збільшилась в 50 разів? Температурний коефіцієнт швидкості реакції дорівнює 1,8.
101.Розрахувати температурний коефіцієнт швидкості реакції, якщо константа швидкості її при 100°С складає 6×10-4, а при 150°С - 7,2×10-2.
102. Температурний коефіцієнт швидкості однієї реакції дорівнює 3, другої - 4. При певній температурі константа швидкості другої реакції в 3 рази більше константи швидкості першої. На скільки слід збільшити температуру, щоб константа швидкості другої реакції в 5 разів була більша, ніж константа швидкості першої?
103. При температурі 100°С швидкість однієї реакції в 2 рази більше швидкості другої. Температурний коефіцієнт першої реакції дорівнює 2, другої - 4. При якій температурі швидкості обох реакцій зрівняються?
104. Записати вирази констант для рівнянь таких зворотних реакцій:
1) 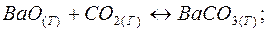
2) 
3) 
4) 
105. Виразити константу рівноваги реакції  через константи рівноваги реакцій:
через константи рівноваги реакцій:
1) 
2) 
3) 
106. Виразити константу рівноваги кожної реакції через константи рівноваг трьох інших реакцій:




107. Розрахувати константу рівноваги в системі  якщо відомо, що спочатку була приготовлена суміш, яка містила 4 моль нітроген(II) оксиду та 2 моль кисню, а в момент рівноваги в суміші залишилось 20 % початкової кількості нітроген(II) оксиду. Який тиск газової суміші в момент рівноваги, якщо реакція перебігає в закритому посуді об’ємом 1 л та вихідний тиск дорівнював 2,026×105 Па, а температура була сталою?
якщо відомо, що спочатку була приготовлена суміш, яка містила 4 моль нітроген(II) оксиду та 2 моль кисню, а в момент рівноваги в суміші залишилось 20 % початкової кількості нітроген(II) оксиду. Який тиск газової суміші в момент рівноваги, якщо реакція перебігає в закритому посуді об’ємом 1 л та вихідний тиск дорівнював 2,026×105 Па, а температура була сталою?
108. Хімічна реакція проходить в розчині згідно з рівнянням  . Як зміниться її швидкість, якщо концентрацію
. Як зміниться її швидкість, якщо концентрацію 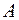 збільшити в два рази, а концентрацію
збільшити в два рази, а концентрацію 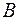 залишити незмінною.
залишити незмінною.
109. Хімічна реакція проходить в розчині згідно з рівнянням  . Як зміниться її швидкість, якщо концентрацію обох речовин збільшити в два рази?
. Як зміниться її швидкість, якщо концентрацію обох речовин збільшити в два рази?
110. В який бік зміститься рівновага в реакції  при підвищенні тиску?
при підвищенні тиску?
111. Хімічна реакція проходить в розчині згідно з рівнянням  . Як зміниться її швидкість, якщо концентрацію обох речовин збільшити в два рази?
. Як зміниться її швидкість, якщо концентрацію обох речовин збільшити в два рази?
112. В який бік зміститься рівновага в реакції  при підвищенні тиску?
при підвищенні тиску?
113. Хімічна реакція проходить в розчині згідно з рівнянням  . Як зміниться її швидкість, якщо збільшити тиск на реагуючу суміш в два рази, вважаючи, що реакція перебігає між газоподібними речовинами?
. Як зміниться її швидкість, якщо збільшити тиск на реагуючу суміш в два рази, вважаючи, що реакція перебігає між газоподібними речовинами?
114. В який бік зміститься рівновага в реакції 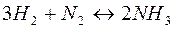 при зниженні тиску?
при зниженні тиску?
115. Хімічна реакція проходить в розчині згідно з рівнянням  . Як зміниться її швидкість, якщо концентрацію
. Як зміниться її швидкість, якщо концентрацію 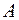 зменшити в два рази, а концентрацію
зменшити в два рази, а концентрацію 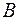 залишити незмінною.
залишити незмінною.
116.В який бік зміститься рівновага в реакції  при зниженні тиску?
при зниженні тиску?
117. Хімічна реакція перебігає в розчині згідно з рівнянням  . Як зміниться її швидкість, якщо концентрацію обох речовин зменшити вдвічі?
. Як зміниться її швидкість, якщо концентрацію обох речовин зменшити вдвічі?
118. В який бік зміститься рівновага в реакції  при зниженні тиску (всі речовини знаходяться в газоподібному стані)?
при зниженні тиску (всі речовини знаходяться в газоподібному стані)?
119. Хімічна реакція перебігає в розчині згідно з рівнянням  . Як зміниться її швидкість, якщо зменшити тиск на реагуючу суміш в два рази, вважаючи, що реакція перебігає між газоподібними речовинами?
. Як зміниться її швидкість, якщо зменшити тиск на реагуючу суміш в два рази, вважаючи, що реакція перебігає між газоподібними речовинами?
120. В який бік зміститься рівновага в реакції  при зниженні концентрації азоту?
при зниженні концентрації азоту?
2.11 Приклади рішення типових задач з теми
“Теорія електролітичної дисоціації”
Приклад 1. Якою є молярність розчину сульфатної кислоти з масовою часткою 15 % (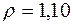
 ?
?
Розв’язання: Молярна концентрація визначається кількістю молів розчиненої речовини в об’ємі розчину:
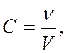
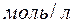 .
.
Відомо, що масова частка сульфатної кислоти складає 15 %. Це означає, що у 100 г розчину міститься 15 г сульфатної кислоти.

де  - маса розчиненої речовини,
- маса розчиненої речовини, 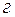 ;
;
 - молекулярна маса речовини,
- молекулярна маса речовини, 
 =2×1+32+4×16=98
=2×1+32+4×16=98 
 =
=  =0,15
=0,15 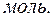

де  - маса розчину,
- маса розчину, 
 - густина розчину,
- густина розчину, 

 ,
,


Відповідь: 

Приклад 2. Яку масу натрій хлориду необхідно розчинити в колбі на 200 мл, щоб одержати 0,2 н. розчин?
Розв’язання: Нормальність розчину (молярна концентрація еквіваленту) дорівнює відношенню кількості моль еквівалентів розчиненої речовини до об’єму розчину:


Кількість моль розчиненої речовини визначають за формулою:
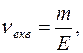
де  - маса розчиненої речовини,
- маса розчиненої речовини, 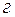 ,
,
 - еквівалентна маса речовини,
- еквівалентна маса речовини, 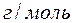 .
.
Вираз для нормальної концентрації можна записати у вигляді:  ,
,
 .
.
Еквівалент складної речовини можна розрахувати за формулою:
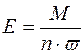 ,
,
де  - молекулярна маса речовини,
- молекулярна маса речовини, 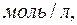
 - кількість атомів металу,
- кількість атомів металу,
 - валентність металу.
- валентність металу.




Відповідь: 

Приклад 3. Розрахувати  0,1 н. розчину
0,1 н. розчину  , якщо ступінь дисоціації складає 1 %.
, якщо ступінь дисоціації складає 1 %.
Розв’язання: Дисоціацію амоніаку можна відобразити схемою:

Ступінь дисоціації дорівнює відношенню кількості молекул, що розпалися на іони до загальної кількості молекул, тобто
 %.
%.
Звідси  ;
; 


 ,
, 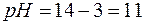 .
.
Відповідь:  .
.
Питання та задачі до контрольних робіт з теми
“Теорія електролітичної дисоціації”
121.Сформулюйте основні положення теорії електролітичної дисоціації.
122.Що таке ступінь дисоціації та константа дисоціації? Наведіть приклади сильних електролітів.
123.Що таке електроліт? Які з наведених сполук є сильними електролітами:
а)  ; б)
; б)  ; в)
; в) 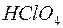 ; г)
; г)  ; д)
; д)  .
.
124. Напишіть рівняння реакцій дисоціації  за двома ступенями та вирази відповідних констант дисоціації.
за двома ступенями та вирази відповідних констант дисоціації.
125. Написати рівняння процесів електролітичної дисоціації, що відбуваються в розчинах наступних речовин:  ,
, 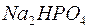 ,
,  .
.
126. Чи однакова концентрація гідроген-іонів в розчинах різних одноосновних кислот однакової молярної концентрації? Відповідь обґрунтуйте на прикладі двох кислот: 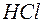 та
та 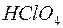 (Kд=5×10–8).
(Kд=5×10–8).
127. Наведіть приклади буферних розчинів. Для чого їх використовують?
128. Написати рівняння процесів електролітичної дисоціації, що відбуваються в розчинах таких речовин: 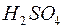 ,
,  ,
,  .
.
129. Скласти молекулярні рівняння реакцій:

 ;
;
 .
.
130. Скласти молекулярні та іонні рівняння реакцій, які перебігають між речовинами  та
та 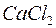 ,
, 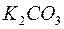 та
та  ,
,  та
та  .
.
131. Скласти іонні та молекулярні рівняння розчинення купрум(ІІ) гідроксиду в розчині нітратної кислоти.
132. Скласти молекулярні рівняння реакцій, які виражаються іонними:
 ;
;
 ;
;
 .
.
133. Cкладіть іонні та молекулярні рівняння реакцій, які перебігають між речовинами 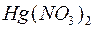 та
та 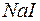 ,
,  та
та  ,
,  та
та  .
.
134. До кожної з речовин:  ,
,  ,
,  ,
,  додали розчин сульфатної кислоти. В яких випадках відбулися реакції? Написати їх іонні та молекулярні рівняння.
додали розчин сульфатної кислоти. В яких випадках відбулися реакції? Написати їх іонні та молекулярні рівняння.
135. Скласти іонні та молекулярні рівняння реакцій, які перебігають між речовинами:  та
та 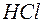 ,
,  та
та  ,
,  та
та  .
.
136. Яку масу натрій нітрату необхідно взяти для приготування: а) 100 г розчину з масовою часткою 30 %; б) 250 мл 0,3 М розчину; с) 420 мл 0, 45 н. розчину.
137. Яку масу динатрій сульфату необхідно взяти для приготування: а) 100 г розчину з масовою часткою 50 %; б) 350 мл 0,25 М розчину; с) 400 мл 0, 5 н. розчину.
138. Яку масу нікель(II) сульфату необхідно взяти для приготування: а) 150 г розчину з масовою часткою 10 %; б) 350 мл 0,2 М розчину; с) 500 мл 0, 5 н. розчину.
139. Яку масу купрум(II) сульфату необхідно взяти для приготування: а) 350 г розчину з масовою часткою 10%; б) 350 мл 0,2 М розчину; с) 500 мл 0, 5 н. розчину.
140. Яка маса калій хлориду міститься в 400 мл розчину з молярною концентрацією 0,3 моль¤л?
141. Який об’єм води потрібен для того, щоб розчиненням 40 г  одержати розчин з масовою часткою
одержати розчин з масовою часткою  8 %?
8 %?
142. Маємо 0,01 н. розчин барій(II) гідроксиду 
 . Розрахувати молярність, моляльність розчину та масову частку барій(II) гідроксиду в розчині.
. Розрахувати молярність, моляльність розчину та масову частку барій(II) гідроксиду в розчині.
143. Розрахувати моляльність розчину глюкози ( ), якщо в 280 г води її міститься 40 г?
), якщо в 280 г води її міститься 40 г?
144. У 400 г води розчинено 10 г сахарози ( ). Визначити моляльність одержаного розчину?
). Визначити моляльність одержаного розчину?
145. У 450 г розчину містится 30 г дикалій сульфату. Знайти масову частку дикалій сульфату в розчині. Чому дорівнює моляльність цього розчину?
146. У 750 г розчину знаходиться 50 г ферум(II) сульфату. Чому дорівнює моляльність цього розчину?
147. У 300 г розчину знаходиться 50 г купрум(II) сульфату. Розрахувати моляльність цього розчину.
148. Cкільки води треба додати до 100 мл розчину нітратної кислоти з масовою часткою 48 %, густина якої 1,303 г/см3, щоб отримати розчин з масовою часткою 20 %?
149. Визначте масову частку розчину нітратної кислоти, якщо до 500 г її розчину з масовою часткою 32 % додати 1 л води?
150.Скільки грамів  треба взяти для приготування 300 г розчину з масовою часткою 5 %, який розраховується на безводну сіль?
треба взяти для приготування 300 г розчину з масовою часткою 5 %, який розраховується на безводну сіль?
151.Cкільки кристалічної соди  необхідно взяти для приготування 0,5 л 0,01 н. розчину?
необхідно взяти для приготування 0,5 л 0,01 н. розчину?
152. Змішали 100 мл розчину сульфатної кислоти з масовою часткою 50 % 
 та 100 мл розчину сульфатної кислоти 50 з масовою часткою 10 % (густина 1,07
та 100 мл розчину сульфатної кислоти 50 з масовою часткою 10 % (густина 1,07  . Суміш розбавили водою до 3 л. Визначити нормальність одержаного розчину?
. Суміш розбавили водою до 3 л. Визначити нормальність одержаного розчину?
153. Який об’єм розчину сульфатної кислоти з масовою часткою 96 % (густина 1,84  буде потрібний для приготування 3 л 0,4 н. розчину?
буде потрібний для приготування 3 л 0,4 н. розчину?
154.Які об’єми 2 та 6 М розчинів хлоридної кислоти треба змішати для одержання 0,5 л 3 М розчину?
155. Скільки води треба додати до розчину калій нітрату з масовою часткою 25%, щоб приготувати 300 г розчину з масовою часткою 7 %?
156. Яку кількість калій нітрату необхідно додати до 200 мл 0,1 н. розчину  , щоб одержати розчин з концентрацією 0,15 н.?
, щоб одержати розчин з концентрацією 0,15 н.?
157. До якого об’єму необхідно розбавити 30 мл розчину  з масовою часткою 20 %
з масовою часткою 20 % 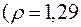
 , щоб одержати розчин з молярною концентрацією 0,5 моль/л
, щоб одержати розчин з молярною концентрацією 0,5 моль/л 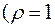
 .
.
158. Який об’єм води слід додати до 1 л 50 %-го розчину сульфатної кислоти 
 щоб одержати 1 н. розчин
щоб одержати 1 н. розчин 
 .
.
159. Розрахувати масову долю  в розчині, який одержали змішуванням 100 мл 10 %-го
в розчині, який одержали змішуванням 100 мл 10 %-го 
 та 150 мл 20 %-го
та 150 мл 20 %-го 
 розчинів
розчинів  .
.
160. Яку масу нікель(II) сульфату необхідно додати до 250 мл 0,15 н. розчину  , щоб довести концентрацію до 0,2 н.?
, щоб довести концентрацію до 0,2 н.?
161. Які об’єми 20 %-го 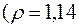
 та 6 %-го
та 6 %-го 
 розчинів сульфатної кислоти необхідно взяти для приготування 5 л 10 %-го розчину
розчинів сульфатної кислоти необхідно взяти для приготування 5 л 10 %-го розчину 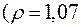
 ?
?
162. До 100 мл 0,25 н. розчину алюміній(III) нітрату додали 200 мл 0,6 М розчину цієї солі. Розрахувати молярну концентрацію еквіваленту одержаного розчину.
163. Чому дорівнюють маси барій хлориду безводного та кристалогідрату  , які необхідно взяти для приготування розчину об’ємом 1,5 л
, які необхідно взяти для приготування розчину об’ємом 1,5 л 
 , в якому
, в якому  =8 %? Який об’єм води необхідно взяти в першому та другому випадках?
=8 %? Який об’єм води необхідно взяти в першому та другому випадках?
164. До 150 мл 0,15 М розчину аргентум нітрату додали 200 мл 0,2 н. розчину цієї солі. Розрахувати молярну концентрацію еквівалента одержаного розчину.
165. Який об’єм 5 %-го розчину натрій гідроксиду 
 необхідно додати до 100 мл 20 %-го розчину
необхідно додати до 100 мл 20 %-го розчину 
 , щоб одержати 15 %-ний розчин?
, щоб одержати 15 %-ний розчин?
166. Які об’єми 50 %-го 
 і 10 %-го
і 10 %-го 
 необхідно взяти для приготування 1 л 20 %-го розчину
необхідно взяти для приготування 1 л 20 %-го розчину 
 ?
?
167. Яка маса: а) 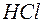 у розчині об’ємом 750 мл, якщо масова частка хлоридної кислоти складає 10 %
у розчині об’ємом 750 мл, якщо масова частка хлоридної кислоти складає 10 % 
 ? б)
? б)  у розчині об’ємом 200 мл, якщо
у розчині об’ємом 200 мл, якщо  =30 %
=30 % 
 ?
?
168. Чому дорівнює об’єм води, який необхідно додати до розчину масою 1 кг, щоб зменшити масову частку розчиненої речовини з 50 до 10 %?
169. Після випарювання 10 %-го розчину 

 об’ємом 6 л його маса стала дорівнювати 1420 г. Розрахуйте масову частку натрій гідроксиду в одержаному розчині.
об’ємом 6 л його маса стала дорівнювати 1420 г. Розрахуйте масову частку натрій гідроксиду в одержаному розчині.
170.Обчисліть молярну концентрацію та нормальність розчину кальцій хлориду з масовою часткою 20 % 
 .
.
171. Чому дорівнює нормальність розчину натрій гідроксиду з масовою часткою 30 % 
 ? До 1 л цього розчину додали 5 л води. Обчисліть мосову частку одержаного розчину.
? До 1 л цього розчину додали 5 л води. Обчисліть мосову частку одержаного розчину.
172. Розрахувати масову частку  у розчині, який одержали змішуванням 250 мл 10 %-го
у розчині, який одержали змішуванням 250 мл 10 %-го 
 та 50 мл 20 %-го
та 50 мл 20 %-го 
 розчинів
розчинів  .
.
173. Який об’єм розчину, в якому масова частка сульфатної кислоти складає 80 % 
 , необхідно взяти для приготуваня 600 мл розчину з молярною концентрацією еквіваленту 0,1 моль¤л?
, необхідно взяти для приготуваня 600 мл розчину з молярною концентрацією еквіваленту 0,1 моль¤л?
174. Маємо 10 % розчин сульфатної кислоти 
 . Розрахувати молярність, молярну концентрацію еквіваленту цього розчину.
. Розрахувати молярність, молярну концентрацію еквіваленту цього розчину.
175. Якої маси кристалогідрат  та вода якого об’єму знадобляться для приготування розчину
та вода якого об’єму знадобляться для приготування розчину 

 об’ємом 1,2 л з масовою часткою 10 %?
об’ємом 1,2 л з масовою часткою 10 %?
176. У 350 г розчину міститься 10 г натрій хлориду. Розрахувати моляльність розчину та мольну долю натрій хлориду в розчині.
177. Яку масу дикалій карбонату необхідно додати до 200 мл 0,05 н. розчину 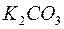 , щоб довести концентрацію до 0,12 н.?
, щоб довести концентрацію до 0,12 н.?
178. До 30 мл 0,2 М розчину цинк нітрату додали 150 мл 0,2 н. розчину цієї солі. Розрахувати молярну концентрацію еквіваленту одержаного розчину.
179. Маємо 25 % розчин хлоридної кислоти 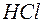

 . Розрахувати молярність, молярну концентрацію еквіваленту цього розчину.
. Розрахувати молярність, молярну концентрацію еквіваленту цього розчину.
180.Розрахувати масову долю нітратної кислоти у розчині, який одержали змішуванням 200 мл 5 %-го 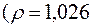
 та 150 мл 60 %-го
та 150 мл 60 %-го 
 розчинів
розчинів  .
.
181. Розрахувати  0,2 н. розчину
0,2 н. розчину 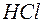 .
.
182. Розрахувати  розчину, якщо
розчину, якщо  =3,5
=3,5 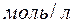 .
.
183. Концентрація гідроксид-іонів у водному розчині дорівнює 1×10–3 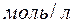 . Визначити
. Визначити  та
та 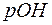 розчину.
розчину.
184. Концентрація гідроксид-іонів водного розчину дорівнює 5×10–2 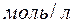 . Визначити
. Визначити  та
та 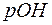 розчину.
розчину.
185. Чому дорівнює  розчинів, в яких
розчинів, в яких 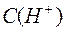 дорівнює 0,15, 0,01, 10–6, 10–11
дорівнює 0,15, 0,01, 10–6, 10–11 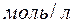 ;
;  дорівнює 0,1 та 10–10
дорівнює 0,1 та 10–10 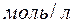 ?
?
186. Знайти концентрацію  та
та 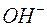 іонів в розчинах, для яких
іонів в розчинах, для яких  дорівнює: а) 5; б) 10,5.
дорівнює: а) 5; б) 10,5.
187. Розрахувати концентрацію іонів  та
та  в розчинах, якщо концентрація
в розчинах, якщо концентрація 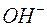 дорівнює: a) 10–6
дорівнює: a) 10–6 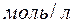 ; б) 4×10–2
; б) 4×10–2 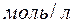 .
.
188. Чому дорівнює  у 0,05 н. розчині
у 0,05 н. розчині  , якщо a=0,01?
, якщо a=0,01?
189. Визначити 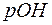 та
та 
 розчину кислоти, якщо
розчину кислоти, якщо  дорівнює 3?
дорівнює 3?
190. Визначити 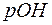 та
та  розчину кислоти, якщо
розчину кислоти, якщо  дорівнює 2,5?
дорівнює 2,5?
191. Розрахувати  0,1 М розчину сульфатної кислоти, якщо ступінь її дисоціації дорівнює 90 %.
0,1 М розчину сульфатної кислоти, якщо ступінь її дисоціації дорівнює 90 %.
192. Розрахувати концентрацію гідроген-іонів в 0,2 н. розчині  , якщо ступінь дисоціації її в цьому розчині дорівнює 0,045 %.
, якщо ступінь дисоціації її в цьому розчині дорівнює 0,045 %.
193. Чому дорівнює ступінь дисоціації етаноатної кислоти в 0,01 н. розчині, якщо 
194. Яке значення рН мають розчини 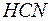 , в яких ступінь дисоціації кислоти дорівнює: а) 0,0265 %; б) 0,0084 %?
, в яких ступінь дисоціації кислоти дорівнює: а) 0,0265 %; б) 0,0084 %?
195. Степінь дисоціації  у розчині з концентрацією 0,1
у розчині з концентрацією 0,1 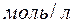 дорівнює 0,08 %. При якій концентрації розчину вона збільшиться: в 2 рази, в 10 раз?
дорівнює 0,08 %. При якій концентрації розчину вона збільшиться: в 2 рази, в 10 раз?
196. Розрахуйте  0,171 %-ного розчину барій(II) гідроксиду, якщо a = 1, а густину розчину прийняти рівною 1 г¤см3.
0,171 %-ного розчину барій(II) гідроксиду, якщо a = 1, а густину розчину прийняти рівною 1 г¤см3.
197. Розрахувати молярну концентрацію кислоти  у розчині, якщо
у розчині, якщо  =5,8;
=5,8;
a = 0,001.
198. Як зміниться  0,2 М розчину хлоридної кислоти після додавання до нього рівного об’єму води?
0,2 М розчину хлоридної кислоти після додавання до нього рівного об’єму води?
199. Змішали рівні об’єми розчинів сильних кислот з  та
та  . Розрахувати
. Розрахувати  та
та 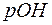 одержаного розчину.
одержаного розчину.
200. Як зміниться  розчину після додавання до 300 мл 0,3 н. розчину
розчину після додавання до 300 мл 0,3 н. розчину  200 мл води?
200 мл води?
201. Розрахувати концентрацію гідроген-іонів в розчині калій гідроксиду (a = 1), якщо відомо, що в 10 мл розчину міститься 0,028 г  .
.
202. Розрахувати концентрацію гідроген-іонів в 0,1 н. розчині етаноатної кислоти (Кд = 1,8×10–5).
203. Яку молярну концентрацію мають розчини 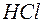 та
та  , якщо
, якщо  їх розчинів дорівнюють 1,6 та 12,6 відповідно?
їх розчинів дорівнюють 1,6 та 12,6 відповідно?
204. Чому дорівнює  розчинів, в яких
розчинів, в яких  дорівнює 0,1, 0,001, 10–7, 10–10 моль¤л;
дорівнює 0,1, 0,001, 10–7, 10–10 моль¤л;  дорівнює 0,01 та 10–11
дорівнює 0,01 та 10–11 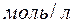 ?
?
205. Розрахуйте  0,002 н. розчину нітратної кислоти.
0,002 н. розчину нітратної кислоти.
206. Скільки води слід додати до 200 мл хлоридної кислоти з  2, щоб змінити величину рН на одиницю?
2, щоб змінити величину рН на одиницю?
207. Скільки грамів хлоридної кислоти слід додати до 2 л її розчину з  3,5, щоб знизити
3,5, щоб знизити  розчину до 3?
розчину до 3?
208. Розрахувати  0,2 М розчині сульфатної кислоти, якщо ступінь її дисоціації дорівнює 90%.
0,2 М розчині сульфатної кислоти, якщо ступінь її дисоціації дорівнює 90%.
209. У розчині  концентрації 0,15
концентрації 0,15 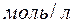 ступінь її дисоціації дорівнює 0,08 %. При якій концентрації розчину вона збільшиться: в 3 рази, в 10 раз?
ступінь її дисоціації дорівнює 0,08 %. При якій концентрації розчину вона збільшиться: в 3 рази, в 10 раз?
210. Знайдіть a та концентрацію гідроген-іонів у наступних розчинах кислот:
| Формула кислоти | Молярна концентрація, моль/л | Константа дисоціації |

| 0,001 | 
|

| 0,1 | 
|
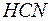
| 0,05 | 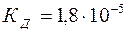
|

| 0,02 | 
|
2.13 Приклади рішення типових задач з теми
“Рівновага у розчинах солей, які піддаються гідролізу”
Приклад 1. У розчинах яких солей  : а)
: а) 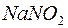 ; б)
; б)  ; в)
; в) 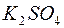 .
.
Розв’язання:
Гідроліз солі - це взаємодія солі з водою, при якій складові частини солі з’єднуються зі складовими частинами води.
а) натрій нітрат - сіль, яка утворена сильним лугом  та слабкою кислотою
та слабкою кислотою  , тому вона гідролізується:
, тому вона гідролізується:


Розчин солі буде мати лужне середовище 
б) купрум(II) сульфат - сіль утворена слабкою основою  та сильною кислотою
та сильною кислотою 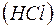 . Це означає, що гідроліз цієї солі буде проходити по катіону. Катіон двохзарядний, тому гідроліз буде проходити за ступенями:
. Це означає, що гідроліз цієї солі буде проходити по катіону. Катіон двохзарядний, тому гідроліз буде проходити за ступенями:

 .
.
Розчин солі буде мати кисле середовище 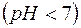 .
.
в) калій сульфат - сіль утворена лугом  та сильною кислотою
та сильною кислотою  , тому ця сіль гідролізу не підлягає. При розчиненні солі відбувається тільки її дисоціація:
, тому ця сіль гідролізу не підлягає. При розчиненні солі відбувається тільки її дисоціація:

Розчин солі буде мати нейтральне середовище  .
.
Питання та задачі до контрольних робіт з теми
“Рівновага у розчинах солей, які піддаються гідролізу”
| № | Які з наведених солей гідролізуються? Напишіть іонні та молекулярні рівняння реакцій. Укажіть середовище цих розчинів. | |
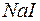 , ,  , ,  , , 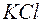
| ||
 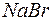 , , 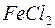 , ,  , , 
| ||
  , ,  , , 
| ||
  , ,  , , 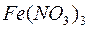
| ||
  , ,  , , 
| ||
  , ,  , , 
| ||
 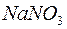 , ,  , , 
| ||
 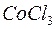 , ,  , , 
| ||
  , ,  , , 
| ||
  , ,  , , 
|
.
221. Продуктом гідролізу яких солей є основні солі: а) 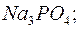 б)
б) 
в) 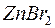 ; г)
; г)  Напишіть іонні реакції їх гідролізу.
Напишіть іонні реакції їх гідролізу.
222. Для розчинів яких солей рН має таке ж значення, як для води? Покажіть це на прикладі  та
та 
223. Чи можна за допомогою індикатору відрізнити друг від друга солі:  і
і 
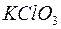 і
і 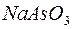 ;
;  і
і  ;
;  і
і 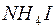 ;
;  і
і 
224. Чи можна за допомогою індикатору відрізнити друг від друга солі:  і
і  ;
;  і
і  ;
;  і
і 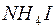 ;
;  і
і 
225. Для якої солі  буде мати більше значення:
буде мати більше значення: 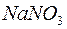 чи
чи  ,
,  чи
чи  ,
,  чи
чи 
2.15 Приклади рішення типових задач з теми
“ Рівновага у розчинах координаційних (комплексних) сполук ”
Приклад 1. Дайте назву комплексним сполукам а)  ; б)
; б) 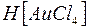 , визначте ступінь окиснення і координаційне число комплексо-утворювача. Напишіть для них рівняння дисоціації та константи нестійкості.
, визначте ступінь окиснення і координаційне число комплексо-утворювача. Напишіть для них рівняння дисоціації та константи нестійкості.
Розв’язання:
а) 
Назва: тетраамінкупрум(II) нітрат.
Комплексоутворювач:  .
.
Ступінь окиснення комплексоутворювача: +2.
Координаційне число комплексоутворювача: 4.
Дисоціація: 1. Первинна: 
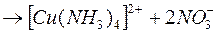 .
.
2.Вторинна:  .
.
Запишемо вираз для константи нестійкості комплексного іону
 :
: 
б) 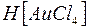
Назва: гідроген тетрахлороаурат  .
.
Комплексоутворювач: Au.
Ступінь окиснення комплексоутворювача: +5.
Координаційне число комплексоутворювача: 4.
Дисоціація: 1. Первинна:  .
.
2.Вторинна:  .
.
Запишемо вираз для константи нестійкості комплексного іону 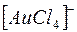 :
:
 .
.
Питання та задачі до контрольних робіт з теми
“Рівновага у розчинах координаційних (комплексних) сполук”
226. Опишіть будову комплексної сполуки на прикладі калій гексаціаноферрату(ІІІ)?
227. які фактори впливають на стійкість комплексних сполук?
228. які принципи можуть лежати в основі класифікації комплексних сполук?
229. що таке іонний асоціат? Навести приклади.
230. назвіть основні типи комплексних сполук?
231. навести приклади зовнішньо- та внутришньосферних комплексних сполук?
232. що таке однороднолігандні та різнолігандні комплекси?
233. що називається поліядерними сполуками?
234. як впливає електронна конфігурація центрального атома на стереохімію комплексної сполуки? Навести приклади.
235. Що таке координаційне число? Що таке максимальне та характеристичне координаційне комплексне число?
236. що визначає дентатність ліганду? Навести приклади моно- та полідентатних лігандів.
237. що таке хелат? У чому полягає сутність хелатного ефекту?
238. які сполуки називаються внутришньокомплексними? Навести приклади.
239. навести приклади координаційно-насичених та координаційно-ненасичених комплексних сполук.
240. які рівноваги мають місце в розчинах комплексних сполук? Як можна охарактеризувати ці рівноваги?
241. що таке ступінчасті та загальні константи стійкості комплексної сполуки?
242. що таке середнє лігандне число, та що воно характеризує?
243. як можна стабілізувати сполуку з нестійкими ступенями окиснення елементу? Покажіть це на прикладах кобальту(ІІІ) та купруму(І).
244. дайте теоретичне обґрунтування (проілюструйте розрахунками) можливості використання комплексних сполук для вибіркового розчинення та осадження малорозчинних сполук.
245. які властивості комплексних сполук мають найбільш велике значення для відкриття та розділення іонів?
246. наведіть приклади використання реакції комплексоутворення для розчинення:
- меркурій(II) та кадмій(II) сульфідів;
- барій та плюмбум сульфатів;
- аргентум та меркурій(І) хлоридів;
- цинк(II), нікол(II), кобальт(II) та алюміній(III) фосфатів.
247. Дайте теоретичне обґрунтування схеми розділення плюмбум(II) хлориду, аргентум(I) хлориду та меркурій(І) хлориду.
248. Наведіть приклади використання реакцій комплексоутворення для розділення:
- кальцій(II)- та стронцій(II)-іонів;
- кальцій(II)- та магній(II)-іонів;
- нікол(II)- та кобальт(II)-іонів;
- алюміній(III)- та ферум(II)-іонів;
- купрум(III)- та кадмій(II)-іонів;
- аргентум(I)- та меркурій(I)-іонів;
- плюмбум(II)- та барій(II)-іонів.
249. наведіть приклади використання комплексних сполук при відкритті елементів.
250. наведіть приклади використання реакцій комплексоутворення для маскування іонів, які заважають відкриттю кобальт(II)-, нікол(II)-, алюміній(III)-, кадмій(II)-іонів.
251. наведіть приклади використання комплексоутворення для зміни кислотно–основних властивостей сполук.
252-263. Дайте назву комплексним сполукам, визначте ступінь окиснення та координаційне число комплексоутворювача. Напишіть для них рівняння дисоціації та константи нестійкості.
| № | Комплексні сполуки |
 i i 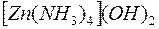
| |
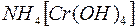 i i 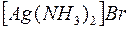
| |
 i i 
| |
 i i 
| |
 i i 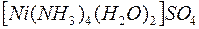
| |
 i i 
| |
 i i 
| |
 i i 
| |
 i i 
| |
 i i 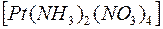
| |
 i i 
| |
 i i 
|
264. На які іони в водних розчинах повністю дисоціюють комплексні сполуки, склад яких виражається наступними молекулярними формулами:  ;
;  ;
;  ;
;  ?
?
265. На які іони в водних розчинах повністю дисоціюють комплексні сполуки, склад яких виражається наступними молекулярними формулами: 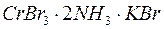 ;
;  ;
; 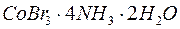 .
.
266. Як за значеннями константи стійкості чи константи нестійкості визначається відносна міцність однотипних комплексних сполук?
267. Напишіть рівняння утворення комплексних кислот та основ при взаємодії:  та
та  ;
;  та
та 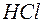 ;
; 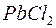 та
та 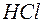 ;
;  та
та  .
.
268. Напишіть рівняння утворення комплексних кислот та основ при взаємодії:  та
та  ;
;  та
та 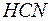 ;
;  та
та  ; PtCl4 та
; PtCl4 та 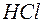 .
.
Дата добавления: 2015-07-25; просмотров: 499 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Приклади рішення типових задач з теми | | | Уважаемые Туристы, для заказа тура в Агенстве Вашего города, ПРОСИМ Вас, иметь при себе Заграничный паспорт и Украинский паспорт, либо копии этих документов. |