
Читайте также:
|
Электрический аккумулятор – устройство, в котором химическая энергия заложенных в него активных веществ непосредственно преобразуется в электрическую при протекании электрохимических реакций.
Устройство такого типа называется химическим источником тока, но в отли-чие от гальванических элементов, является вторичным и предназначено для многократного использования за счет восстановления химической энергии ве-ществ.
5.1. Конструкция аккумуляторов
Устройство почти всех свинцовых аккумуляторов одинаково и основано на принципе баночной конструкции. Широкое применение этих аккумуляторов обусловлено их дешевизной, надежностью в работе и хорошими показателями. Они обладают высоким и стабильным напряжением, мало меняющимся с тем-пературой и токами нагрузки. Ресурс свинцовых аккумуляторов составляет не-сколько сотен зарядно – разрядных циклов.
Электродный блок помещается в баке из кислотостойкого изоляционного материала. Сама блочная структура представляет собой параллельное соедине-ние разнополярных пластин, дающее аккумулятору низкое внутреннее сопро-тивление, что очень важно для стартерных батарей. При сборке аккумуляторов полублоки положительных и отрицательных пластин вводят друг в друга и изолируются сепараторами. Назначение сепараторов состоит в предотвращении соприкосновения разнополярных электродов. Сепараторы способствуют также доступу жидкого электролита по всем участкам электродов.
Расстояние между верхними кромками пластины и крышкой аккумулятора составляет не менее 20 мм. Это расстояние необходимо для компенсации коле-бания уровня электролита и отделения капель электролита при сильном газовы-делении (“кипении”) в конце заряда. В крышке имеется два отверстия для шты-рей – токовыводов. Еще одно отверстие в крышке предназначено для вентиля-ционной пробки, которое обеспечивает выход газов при саморазряде и переза-ряде, а также для доливки электролита, замера его уровня и концентрации. От-дельные аккумуляторы в батарее соединяются хорошо проводящими свинцовы-ми перемычками, которые в последнее время делаются закрытыми общей крышкой, уменьшая саморазряд батареи во время эксплуатации.
Электроды свинцового стартерного аккумулятора представляют собой отно-сительно жесткий электронопроводящий каркас, пронизанный большим коли-чеством пор, с диаметрами 5-10 мкм для губчатого свинца Pb (отрицательной активной массы) и 1-5 мкм для губки двуокиси PbO2 (положительно активной массы) при объемной пористости около 50 % в заряженном состоянии. Элект-ролит – водный раствор серной кислоты
H2SO4 + H2O,
часть которого всегда диссоциирована на положительные ионы водорода H+ и отрицательные сульфат- ионы SO4; часть H2O – также на ионы H+ и ионы гид-роксильной группы OH- (гидратированные ионы обеих знаков).
5.2. Электролит. Механизмы переноса зарядов
Водный раствор серной кислоты, в котором имеются подвижные ионы электропроводен. Под действием электрического поля в электролите начинает-ся перемещение ионов вдоль направления поля. Скорость миграции каждого иона пропорциональна как напряженности поля, так и величине, которую назы-вают подвижностью данного иона. Подвижность ионов пропорциональна удельной электрической проводимости электролита s (См/м), обратную вели-чину которой, численно равной 1/s, называют удельным сопротивлением электролита r (Ом*м), и связывают с главной величиной определяющей внут-реннее сопротивление аккумулятора.
В очень разбавленных растворах как видно из рис.1 проводимость s растет пропорционально концентрации. При дальнейшем увеличении концент-рации подвижность снижается вследствие межионных взаимодействий, роста вязкости, а кроме того возможно снижение степени диссоциации электролита. Соответственно, рост s замедляется (см. рис.1)
Рис 1. Зависимость удельной электропроводимости серной кислоты
от плотности (концентрации электролита) и температуры.
Область концентрации где s - наибольшее соответствует наименьшему значению удельного сопротивления электролита.
Сильная зависимость s от температуры обусловлена прежде всего изменением подвижности ионов. Так как плотность растворов изменяется с температурой, то всегда указывают при какой температуре производится измерение плотности.
Подвижность ионов связана с другими механизмами переноса ионов, действующими в электролитах свинцовых аккумуляторов – конвективных по-токов жидкости (за счет небольших различий температур и плотностей), а так-же диффузионного переноса реагентов который действует вблизи поверхности электродов, выравнивая концентрацию электролита в порах активных масс и объеме всего аккумулятора.
5.3. Принцип действия
Рассмотрим процессы, происходящие на поверхности обеих электродов.
Губчатый свинец отрицательного электрода частично растворяется в элект-ролите с образованием положительных ионов Pb2+, освободившиеся при этом электроны сообщают электроду отрицательный заряд; ионы свинца могут всту-пать в реакцию с отрицательными ионами сульфата образуя нейтральный суль-фат свинца который имеет слабую растворимость и поэтому может осаждаться на любой поверхности, включая отрицательный электрод.
Pb2+ + SO4 ® PbSO4,
Одновременно с этим двуокись свинца PbO2 положительного электрода, растворяясь в электролите в значительно меньшем количестве, чем губчатый свинец при взаимодействии с водой диссоциируется на ионы четырехвалентно-го свинца Pb4+ и гидроксила OH -. Гидроксильная группа, соединяясь с ионом водорода, образует воду
4 OH- + 4 H+ ® 4 H2O,
ионы Pb4+ сообщают электроду положительный потенциал.
Таким образом, на границе электролита c обеими электродами имеют мес-то два связанных между собой явления [5]:
- адсорбция, т.е. изменение концентрации компонентов раствора вблизи по-верхности электродов;
- пространственное разделение зарядов, формирующее двойной электрический слой и создающее в нем электрическую разность потенциалов.
Поскольку все носители зарядов, создающие на электроде потенциал, ос-таются на нем, пополняя заряд его поверхности (в таком случае говорят, что электроды являются идеально поляризованными), а также то, что адсорбция ионов раствора на электроде обусловлена только кулоновским взаимодействи-ем заряда поверхности с зарядами ионов, то по истечении некоторого времени в системе установится динамическое равновесие между электростатическими си-лами системы зарядов. Для него характерно: электролит в целом (за исключе-нием пограничных зон, в которых сосредоточен двойной электрический слой) является электронейтральным, т.е. алгебраическая сумма заряда всех ионов рав-на нулю. Толщина двойного электрического слоя, в котором наблюдается изме-нение потенциала, составляет 3 ¸ 4 А. Электроды аккумулятора – эквипотенци-альны (см. рис. 2).
Это равновесие приостанавливает дальнейший ход электрохимических ре-акций, а объёмные заряды на поверхности электродов для плотности электроли-та, например g = 1,25 [г / см3] составляют, соответственно:
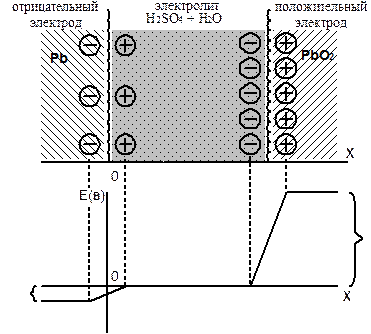
Рис. 2. Строение двойных слоев на границе электролита с обоими
электродами свинцового аккумулятора.
Здесь Dj+ и Dj - – скачки потенциалов на электродах, вызванные работой выхода “основных” носителей за пределы кристаллических решеток материала электродов.
- для отрицательного электрода потенциал Dj- = - 0,38 В;
- для положительного электрода Dj+ = +1,72 В, как видно из рис. 2
Разность электродных потенциалов, измеренная в разомкнутой цепи Dj+ - Dj - даёт значение ЭДС Е0 =2,10 В
Равновесная ЭДС свинцового аккумулятора Е0, как и любого химического источника тока, зависит об химических и физических свойств веществ, прини-мающих участие в токообразующем процессе и совершенно не зависит от раз-меров и формы электродов, а также от количества активных масс и электроли-та. Вместе с тем в свинцовом аккумуляторе электролит принимает непосред-ственное участие в токообразующем процессе на аккумуляторных электродах и изменяет свою плотность в зависимости от степени заряженности аккумулято-ров. Поэтому равновесная ЭДС, которая в свою очередь является функцией плотности электролита, будет также функцией степени разряженности аккуму-лятора, температуры и других факторов.
Установившееся равновесие нарушается, когда между электродами по внеш-ней цепи пойдет ток: электроны с отрицательного электрода устремляются к положительному, потенциальный барьер снижается, на смену ушедшим элект- ронам приходят новые. На положительном электроде ионы Pb4+ присоединяя электроны, пришедшие по внешней цепи, восстанавливаются до ионов двухва-лентного свинца
Pb4+ + 2е- ® Pb2+,
которые взаимодействуют с ионами SO4 образуют сернистый свинец (сульфат свинца) PbSO4 который осаждается на поверхности положительного электрода (см. рис.2)
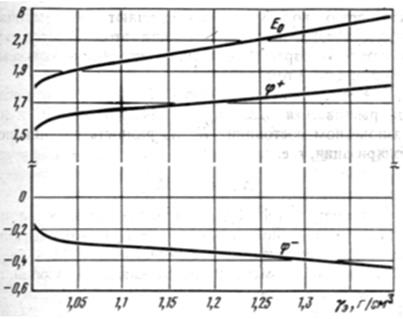
Рис. 3. Зависимость равновесной ЭДС и потенциалов электродов свинцового аккумулятора от плотности электролита.
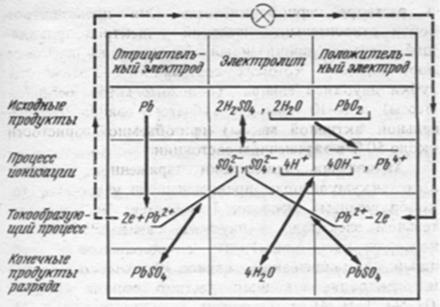
Рис. 4. Схема электрохимических процессов при разряде свинцового аккумулятора
Следовательно, в результате разряда аккумулятора активные материалы положительного и отрицательного электродов преобразуются в сульфат свинца PbSO4. При этом расходуется серная кислота Н2SO4, а из ионов H+ и OH- обра-зуется вода, что приводит к снижению уровня электролита при разряде:
- на отрицательном электроде Pb - 2е + SO4 ® PbSO4 ,
- на положительном электроде - PbО2 + 2е + 4H+ SO4 ® PbSO4 + 2 Н2O.
По плотности электролита поэтому судят о разряде.
Схема электрохимических процессов при заряде аккумулятора показана на рис. 5.
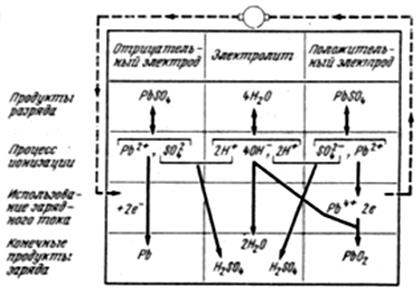
Рис. 5. Схема электрохимических процессов при заряде свинцового аккумулятора
В электролите у обоих электродов присутствуют в небольшом количестве ионы сульфата свинца (Pb+ , SO4) и воды (H+, ОH-).
Под влиянием напряжения источника постоянного тока во внешней цепи ус-танавливается направленное движение электронов к отрицательному электроду.
Двухвалентные ионы свинца у отрицательного электрода нейтрализуются поступившими двумя электронами, превращая активную массу отрицательного электрода в металлический губчатый свинец: Pb2+ +2е ® Pb, ионы SO4 и 2 Н+ образуют серную кислоту:
SO4 + 2Н+ ® Н2SO4.
У положительного электрода под действием зарядного тока двухвалентные ионы свинца Pb2+ отдают электроны 2е, становясь 4-х валентными ионами свинца Pb4+,которые, соединяясь через промежуточные реакции с двумя иона-ми кислорода, образуют двуокись свинца PbО2. Ионы 2H+ и SO4 образуют сер-ную кислоту, в результате чего растет плотность электролита.
Суммарная реакция зарядного процесса имеет вид
PbSO4 + 2 Н2O ® PbО2 + Pb + 2H2SO4.
Когда процессы преобразования веществ в активных массах положительно-го и отрицательного электронов окончены, плотность электролита перестает из-меняться, то это служит признаком окончания процесса заряда аккумулятора. При дальнейшем продолжении заряда начинается процесс активного электро-литического разложения воды на Н2 и О2, которые выделяются у электролита создают эффект его “кипения”, что также является признаком окончания заряд-ного процесса.
5.4. Емкость аккумулятора
Максимальное количество электричества, которое аккумуляторная батарея отдает при полном её разряде называют разрядной емкостью Ср. Разрядная ем-кость зависит от количества активного вещества электродов и электролита. Чем больше это количество, тем дольше может поддерживаться токообразующая ре-акция и тем больше емкость. Разрядную емкость можно вычислить умножив силу разрядного тока Iр на продолжительность разряда tр
Ср = ò Iр dt = Iр tр (при условии, что Iр = const)
Емкость аккумуляторов принято выражать в ампер-часах (А-ч). Под номи-нальной емкостью понимают параметры, относящиеся к номинальному режиму разряда и гарантируемые изготовителем. Фактические значения емкости в этом режиме обычно превышают гарантированные значения на 5 ¸ 10%.
На степень использования активной массы и на величину разрядной емкос-ти оказывают влияние следующие основные факторы.
1. Пористость активной массы
С увеличением пористости улучшаются условия диффузии электролита в глубину активной массы электрода и увеличивается истинная поверхность, на которой происходит токообразующая реакция, что способствует росту разряд-ной емкости.
2. Пористость и рациональность конструкции материала сепараторов
С ростом пористости сепараторов увеличивается запас электролита в меж-электродном зазоре и улучшаются условия его диффузии. Конструкционно се-параторы предотвращают возникновение электронной проводимости между электродами, удерживают активную массу на электродах, что способствует уве-личению разрядной емкости.
3. Сила разрядного тока, которым аккумулятор должен непрерывно разряжаться в течение заданного времени.
Режимы разряда условно разделяют на длительные при которых разряд происходит максимальными токами в течение нескольких часов (например, 10- и 20- часовые разряды С10 и С20), короткие или стартерные, при которых разряд длится несколько минут, а сила тока в несколько раз больше номинальной ем-кости аккумулятора.
При увеличении разрядного тока скорость разряда поверхностных слоев ак-тивной массы возрастает в большей степени, чем глубинных. В результате рост сернокислотного свинца в устьях пор происходит быстрее, чем в глубине и по-ры закупориваются сульфатом раньше, чем успевает прореагировать ее внут-ренняя поверхность. Вследствие прекращения диффузии электролита внутрь поры реакция в ней прекращается (говорят, наступает пассивация). Таким об-разом, чем больше разрядный ток, тем меньше емкость аккумулятора, а следо-вательно, и коэффициент использования активной массы.
Для оценки пусковых качеств аккумуляторных батарей их емкость характе-ризуют также количеством прерывистых разрядов (например, длительностью 10 – 15 с с перерывами между ними по 60 с). Емкость отдаваемая батареей при прерывистых разрядах, превышает емкость при непрерывном разряде, особенно при стартерном режиме разряда (Iр = 2 ¸ 5 С20).
4. Плотность электролита
При дополнительном повышении плотности электролита емкость положи-тельных электродов увеличивается, в большей мере, чем емкость отрицатель-ных электродов, это сказывается особенно при низкой отрицательной темпера-туре вследствие ускоренной пассивации поверхности электрода. Повышенная плотность электролита также отрицательно сказывается на сроке службы акку-мулятора вследствие ускорения коррозийных процессов на положительном электроде. Поэтому оптимальная плотность электролита устанавливается исхо-дя из совокупности требований и условий в которых эксплуатируется аккуму-ляторная батарея.
5. Температура электролита
С понижением температуры разрядная емкость аккумуляторов уменьшает-ся. Причиной этого является увеличение вязкости электролита и его электри-ческого сопротивления, замедляющее скорость его диффузии в поры активной массы, а также увеличение скорости пассивации отрицательного электрода.
6. Степень заряженности
При увеличении степени заряженности емкость увеличивается и достигает своего максимального значения при полном заряде батареи. Это обусловлено тем, что при неполном заряде батареи количество Pb на отрицательном элект-роде и PbО2 на положительном электроде, а следовательно, и плотность элект-ролита не достигла максимальных значений, поэтому по текущей плотности электролита судят о степени заряженности аккумулятора.
5.5. Разрядная вольт – амперная характеристика аккумуляторной батареи.
Наиболее ответственным режимом работы для стартерных аккумулятор-ных батарей является режим пуска двигателя. Качество стартерных батарей контролируется показателями режима разряда при постоянной силе тока и не-прерывном разряде, однако в ряде случаев используют разрядные вольт – ам-перные характеристики (ВАХ), получаемые в прерывистом разряде.
Разрядные ВАХ выражают зависимость напряжения батареи от силы тока разряда, протекающего через нее, для определенного промежутка времени, про-шедшего с момента включения на разряд.
Разрядная ВАХ в широком диапазоне токов имеет вид, показанный на рис.6.
Рис.6 Экспериментальная (1) и линеаризированная (2) разрядные ВАХ стартерной аккумуляторной батареи
Для оценки стартерных возможностей аккумуляторной батареи практичес-ки необходимый интервал токов составляет от 2С20 до (8 ¸ 10) С20, при кото-рых напряжение на выводах батареи не ниже 7,2 В. В этом интервале токов ВАХ имеет характер близкий линейному, а вне этого интервала ее значения практического применения не имеют, при расчетах же пусковых систем ВАХ считают линейной на всем протяжении (до пересечения с осями координат). Как видно из рис., получены точки пересечения U0 и Iкз , которые носят назва-ние начального разрядного напряжения и тока короткого замыкания.
Если значение внутреннего сопротивления аккумулятора считать постоян-ным, то функциональная зависимость разрядной ВАХ примет вид
Uр = U0 - Iр r
Коэффициент наклона ВАХ батареи характеризует величину ее внутрен-него сопротивления.
Дата добавления: 2015-07-25; просмотров: 100 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Домашняя подготовка | | | Мощность аккумуляторной батареи |