
Читайте также:
|
Энергия активации распада метана в отсутствии катализатора равна 331,0 кДж/моль, а с катализатором – 230,0 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 1 000 К?
Решение:
Скорость химической реакции возрастает в присутствии катализатора. Действие катализатора объясняется тем, что при его участии возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции понижается и активными становятся некоторые молекулы, энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. Обозначим энергию активации реакции без катализатора через Еа, а с катализатором - через 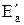 ; соответствующие константы скорости реакции обозначим через k и
; соответствующие константы скорости реакции обозначим через k и 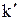 . Используя уравнение Аррениуса, находим
. Используя уравнение Аррениуса, находим
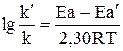 .
.
 Получим
Получим
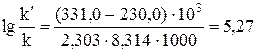 . Окончательно находим
. Окончательно находим 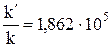 .
.
Таким образом, снижение энергии активации на 101 кДж привело к увеличению скорости реакции в 186 тысяч раз.
При выполнении заданий рекомендуется использовать методические указания [1; 3].
В задачах 285–300 определить константу равновесия обратимых химических реакций при заданной температуре и указать, как будет смещаться равновесие при повышении температуры или давления
| № задачи | Уравнение реакции | Т, К |
| 285. | V2O5(к)+5Fe(к) «2V(к) + 5 FeO(к) | |
| 286. | CO2(г) + H2(г) «CO(г) + H2O(г) | |
| 287. | CO2(г) + H2(г) «CO(г) + H2O(г) | |
| 288. | 2Cu2O(к) + Cu2S(к)«6 Cu(к) + SO2(г) | |
| 289. | TiI4(к) «Ti(к) + 2I2 (г) | |
| 290. | CH4(г) + H2O(г) «3 H2(г) + CO(г) | |
| 291. | Fe2O3(к) + CO(г)«2 FeO(к) + 2CO2(г) | |
| 292. | 3Fe(к) + C(гр) «Fe3C(к) | |
| 293. | SiCl4(г) + 2H2(г) «Si(к) + 4HCl(г) | |
| 294. | GeO2(к) + 4HCl(г) «GeCl4(к) + 2 H2O(г) | |
| 295. | Li2O(к) + 3C(гр.)«Li2C2(к) +CO(г) | |
| 296. | Li3N(к) + 3H2(г) «3 LiH(к) + NH3(г) | |
| 297. | CaCO3 (к)+ 4 C(гр.)«CaC2(к) + 3CO(г) | |
| 298. | WO3(к) + 3H2 (г)«W(к) + 3H2O(г) | |
| 299. | 2 СО + О2 ↔ 2 СО2 | |
| 300. | СОСl2 ↔ CO + Cl2 |
В задачах 301–314 вычислить константу равновесия химической реакции и определить начальные концентрации вступивших в реакцию веществ
| № задачи | Уравнение реакции | Равновесные концентрации См, моль/л |
| Cl2 + CO «COCl2 | См: Cl2=2.5; CO=1.8; COCl2=3.2 | |
| 2NO2«2NO + O2 | См: NO2=0.02; NO=0.08; O2=0.16 | |
| 2SO2 + O2 «2SO3 | См: SO2=0.02; O2=0.4; SO3=0.3 | |
| N2 + 3H2 «2NH3 | См: N2=2.5; H2=1.8; NH3=3.6 | |
| 2NO + O2 «2NO2 | См: NO=0.056; O2=0.028; NO2=0.044 | |
| 2N2 + O2 «2N2O | См: N2=0.072; O2=1.12; N2O=0.84 | |
| H2 + I2 «2HI | См: H2=0.025; I2=0.005; HI=0.009 | |
| N2 + 3H2 «2NH3 | См: N2=3; H2=9; NH3=4 | |
| A + 2B «C | См: A=0.06; B=0.12; C=0.216 | |
| 3 A + B ↔ 2 C | См: A=0.03; B=0.01; C=0.08 | |
| 2 NO2 ↔ 2 NO + O2 | См: NO2 =0,006; NO =0,024; O2=0,012 | |
| CO + Cl2 ↔ COCl2 | См: Cl2 =0,3; CO = 0,2; COCl2=1,2 | |
| 2 SO2 + O2↔ 2SO3 | См: SO2 =0,04; O2=0,06; 2SO3=0,02 | |
| N2 + 3H2 ↔ 2NH3 | См: NH3 = 0,4; N2 = 0,03; H2 = 0,1 |
В задачах 315–319 определить, энергию активации химической реакции по следующим данным:
| № задачи | Температура Т1, К | Константа скорости k1, 1/с | Температура Т2, К | Константа скорости k2, 1/с |
| 1,816×10-4 | 3,996×10-4 | |||
| 3,0×10-2 | 4,0×10-1 | |||
| 7,5 | 4,5×102 | |||
| 4,04×10-5 | 7,72×10-5 | |||
| 2,0×10-2 | 0,38 |
В задачах 320–324 определить, во сколько раз возрастет скорость химической реакции, если температура повысилась на 100 oС
| № задачи | Начальная температура, 0С | Температурный коэффициент, γ |
| 2,50 | ||
| 1,87 | ||
| 3,00 | ||
| 2,00 | ||
| 2,70 |
В задачах 325–329 определить, во сколько раз возрастает скорость химической реакции при применении катализатора по сравнению со скоростью реакции, идущей без катализатора. Реакция идет при температуре 1000 К
| № задачи | Реакция распада | С катализатором | Без катализатора Еа, кДж/моль | |
| катализатор | 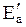 , кДж/моль , кДж/моль
| |||
| CH4 | Pt | 230,0 | 331,0 | |
| N2O | Pt | 136,0 | 244,0 | |
| N2O | Au | 121,0 | 244,0 | |
| HI | Pt | 58,6 | 184,0 | |
| HI | Au | 108,0 | 184,0 |
4. ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Дата добавления: 2015-07-25; просмотров: 166 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Задача 322 | | | Ионно-электронный метод |