
Читайте также:
|
Концентрация растворов – это есть содержание растворенного вещества (в молях или граммах) в определенном объеме или массе раствора или растворителя.
Существуют следующие основные способы выражения концентрации растворов:
1) Массовая доля растворенного вещества – это есть отношение массы растворенного вещества к массе раствора, то есть:

Например, 5 г NaOH содержится в 50 г раствора.
Тогда 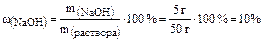
Необходимо помнить, что
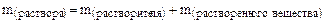
 ,
,
где ρ – плотность раствора (г/мл);
V – объем раствора (мл).
2) Молярная концентрация (или молярность) – это отношение количества растворенного вещества (n) к объему раствора (V) или число молей растворенного вещества в 1 литре раствора, т.е.:

где m – масса растворенного вещества
М – молярная масса растворенного вещества (г/моль)
V – объем раствора (л)
Например, в 500 мл раствора содержится 19,6 г H2SO4.
Тогда, 
то есть в 1 литре раствора содержится 0,4 моль серной кислоты.
3)Молярная концентрация эквивалента растворенного вещества – это есть отношение количества эквивалентов (число молей эквивалентов) растворенного вещества к объему раствора (или число молей эквивалентов растворенного вещества в 1 литре раствора), то есть:
Сн = 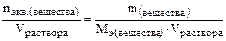
гдеМэ – молярная масса эквивалента растворенного вещества
Например, в 100 мл раствора содержится 9,8 г серной кислоты.
Тогда Сн =  или 2н раствор Н2SO4
или 2н раствор Н2SO4
то есть в 1 литре раствора содержится 2 моль эквивалентов серной кислоты, то есть получился двухнормальный раствор серной кислоты.
3) Моляльная концентрация (или моляльность) – это есть количество (число молей) растворенного вещества в 1 кг растворителя (или в 1000 г растворителя), то есть:
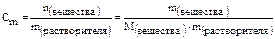

Например, в 200 г воды (то есть растворителя) растворено 4 г NaOH.
Тогда 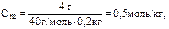 то есть в 1 кг воды содержится 0,5 моля NaOH.
то есть в 1 кг воды содержится 0,5 моля NaOH.
4) Молярная доля растворенного вещества – это отношение количества (числа молей) растворенного вещества к сумме количеств (к сумме молей) всех веществ, составляющих раствор, то есть:

Например, 8 г NaOH растворено в 14,4 г воды.
Тогда 

Отсюда

то есть молярная доля NaOH в растворе равна 0,2.
5) Титр раствора (Т) – это есть число граммов растворенного вещества в 1 мл раствора, то есть:

Например, в 100 мл раствора содержится 5 г серной кислоты.
Тогда 
то есть в 1 мл раствора содержится 0,05 г серной кислоты.
Дата добавления: 2015-07-25; просмотров: 76 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Системы. Растворы | | | Изменение энергии Гиббса, энтальпии и энтропии при образовании раствора. |