
Читайте также:
|
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде.
Энергия возникает в результате взаимодействия оксида свинца и серной кислоты до сульфата (классическая версия). Проведенные в СССР исследования показали, что внутри свинцового аккумулятора протекает как минимум ~60 реакций, порядка 20 из которых протекают без участия кислоты электролита (нехимические)[1]
Во время разряда происходит восстановление диоксида свинца на катоде[2][1] и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Химическая реакция (слева направо — разряд, справа налево — заряд):
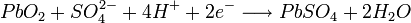
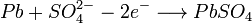
В итоге получается, что при разряде аккумулятора расходуется серная кислота из электролита (и плотность электролита падает, а при заряде, серная кислота выделяется в раствор электролита из сульфатов, плотность электролита растёт). В конце заряда, при некоторых критических значениях концентрации сульфата свинца у электродов, начинает преобладать процесс электролиза воды. При этом на катоде выделяется водород, на аноде — кислород. При заряде не стоит допускать электролиза воды, в противном случае необходимо её долить для восполнения потерянного в ходе электролиза количества.
Дата добавления: 2015-07-25; просмотров: 34 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Принцип действия гальванических элементов | | | Устройство |