
Читайте также:
|
В химических процессах одновременно действуют два противоположных фактора — энтропийный (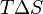 ) и энтальпийный (
) и энтальпийный (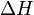 ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (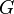 ):
):
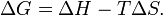
Из этого выражения следует, что 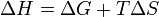 , то есть некоторое количество теплоты расходуется на увеличение энтропии (
, то есть некоторое количество теплоты расходуется на увеличение энтропии (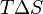 ), эта часть энергии рассеивается в окружающую среду в виде тепла, её часто называют связанной энергией. Другая часть теплоты (
), эта часть энергии рассеивается в окружающую среду в виде тепла, её часто называют связанной энергией. Другая часть теплоты (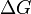 ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При 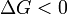 процесс может протекать, при
процесс может протекать, при 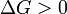 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же 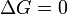 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства 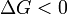 (по кинетическим причинам).
(по кинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса 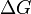 в ходе химической реакции с её константой равновесия
в ходе химической реакции с её константой равновесия 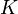 :
:

Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
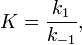
где 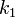 — константа скорости прямой реакции,
— константа скорости прямой реакции, 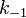 — константа скорости обратной реакции.
— константа скорости обратной реакции.
Дата добавления: 2015-07-25; просмотров: 55 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Связь с химическим потенциалом | | | Что называется скорость химической реакции. Дайте определение средней и мгновенной скорости химической реакции. |