
|
Читайте также: |
Кристалл с определенной химической формулой имеет присущую ему кристаллическую структуру.
Кристаллические структуры - это структуры, представляющие периодическую решетку, в узлах которой расположены атомы. Трехмерная кристаллическая структура представляет решетку, построенную на трех координатных осях x, y, z, расположенных в общем случае под углами a, b, g. Периоды трансляции атомов по осям (параметры решетки) равны, соответственно, a, b, c. Элементарная ячейка кристалла - это параллелепипед, построенный на векторах трансляции a, b, c. Такая ячейка называется примитивной.
В результате трансляции элементарной ячейки в пространстве получается пространственная простая решетка - так называемая решетка Браве. Существует четырнадцать типов решеток Браве. Эти решетки отличаются друг от друга видом элементарных ячеек.
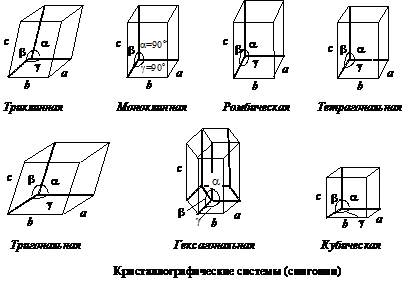
Решетки Браве подразделяются на семь систем, называемых кристаллографическими сингониями, в соответствии с семью различными типами элементарных ячеек: триклинной, моноклинной, ромбической, тетрагональной, тригональной, кубической и гексагональной. Эти элементарные ячейки могут быть как примитивными, так и сложными.
На рисунке изображены сложные элементарные ячейки.
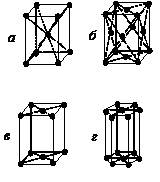
а)объемноцентрированная б)гранецентрированная
в) базоцентрированная г) гексагональная
Объемноцентрированная (ОЦ) ячейка (рис. а) - содержит дополнительно один атом на пересечении пространственных диагоналей куба (или, в общем случае, параллелепипеда). В ОЦ кубической структуре (ОЦК) кристаллизуются такие металлы, как 23V, 24Cr, 26Fe, 41Nb, 73Ta, 74W (индекс слева внизу обозначает номер элемента в периодической системе элементов Д. И. Менделеева).
Гранецентрированная (ГЦ) ячейка (рис. б) - содержит дополнительно по одному атому в плоскости каждой грани. В ГЦ кубической структуре (ГЦК) кристаллизуются металлы 13Al, 28Ni, 29Cu, 47Ag, 78Pt, 79Au и др.
Базоцентрированная (БЦ) ячейка (рис. в) - содержит дополнительно по одному атому в центрах противоположных граней.
Гексагональная ячейка (рис. г) состоит из трех примитивных ячеек, и, как и БЦ ячейка, содержит по одному атому в центре противоположных граней. В гексагональной структуре кристаллизуются многие металлы - 22Ti, 27Co, 30Zn, 39Y, 40Zr, 64Gd, 71Lu.
Различные кристаллографические систем отличаются друг от друга формой элементарной ячейки: соотношениями между длинами ребер a, b и c и углами α, β и γ между гранями.
В триклинной системе (где нет осей и плоскостей симметрии) такая ячейка представляет собой параллелепипед, все ребра и углы которого не равны между собой. В моноклинной - это наклонный параллелепипед; в ромбической (или орторомбической) - прямоугольный параллелепипед с неравными ребрами, в тетрагональной - прямоугольный параллелепипед, в основании которого лежит квадрат; в тригональной (ромбоэдрической) - прямоугольный ромбоэдр, стороны которого равны, а углы одинаковы, но отличны от 90о и меньше, чем 120о; в гексагональной - прямую призму, основанием которой является ромб с углами 120о и 60о, а три ячейки составляют шестигранную призму; в кубической системе элементарная ячейка представляет собой куб.
В настоящее время выделено уже более тысячи структурных типов, однако они охватывают лишь несколько процентов известных кристаллических структур.
В международной классификации по группам структур принята следующая классификация:
А - элементы;
В - соединения типа АВ (например, NaCl, CsI);
С - соединения типа AB2 (CaF2, TiO2);
D - соединения типа AnBm (Al2O3);
E - соединения, образованные больше, чем двумя сортами атомов без радикалов или комплексных ионов (например, CuFeS);
F -структуры соединений с двух- или трехатомными ионами (KCNS, NaHF2);
G - соединения с четырехатомными ионами (CaCO3, NaClO3);
H - соединения с пятиатомными ионами (CaSО4.2H2O, CaWO4);
L - сплавы;
S -силикаты.
Разновидности типов внутри группы различаются номерами.
Понятие структурный тип - один из критериев сходства или различия строения кристаллов. Обычно структурный тип относят к названию одного из веществ, кристаллизующихся в нём. Структуры кристаллов, принадлежащих к одному структурному типу, одинаковы до подобия. Структурный тип в кристаллографии определяет относительное расположение частиц (атомов или атомных групп) в кристалле, без указаний абсолютных расстояний между ними. Чтобы описать конкретную структуру, надо указать структурный тип и параметры структуры.
К важнейшим и распространенным структурным типам относятся: структура меди (тип А), структура вольфрама (тип А 2), структура магния (тип А 3), структура алмаза (тип А 4), структура графита (тип А 9), структура каменной соли (тип В 1), структура перовскита (тип Е 2), структура шпинели (тип Н 11).
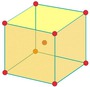
Тип А (Структура меди)
В структурном типе меди кристаллизуются очень многие металлы: золото, серебро, никель, алюминий, кальций, торий, свинец и др. Все эти металлы сравнительно мягкие, пластичные, легко обрабатываются. Многие из них образуют непрерывные ряды твердых растворов, например, Ag-Au, Cu-Au. Структурой типа меди обладают также интерметаллические соединения AuSb, Au2Bi, Au2Pb, Cu2Mg, Bi2K, ZrH, TiH и др.
Элементарная ячейка меди - кубическая, гранецентрированная. Атомы располагаются в вершинах и центрах граней F -ячейки. На элементарную ячейку приходится 4 атома. Каждый атом окружен 12 ближайшими атомами, координационное число (к.ч.) =12. Координационный многогранник - кубооктаэдр. В структуре имеется одна правильная система точек с кратностью 4. Плотнейшие слои 1 перпендикулярны направлениям. Плотнейшая упаковка кубическая трехслойная....АВСАВС....Пространственная группа Fm3m.
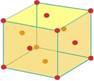
Тип А 2 (Структура вольфрама)
К структурному типу вольфрама (тип ОЦК-металлов) относятся тугоплавкие металлы: хром, ванадий, молибден, ниобий, тантал, -кобальт, -железо, титан, цирконий, гафний, щелочные элементы - литий, натрий, калий, рубидий, цезий, щелочноземельные - кальций, стронций, барий, актиниды - уран, нептуний, плутоний. Из интерметаллических соединений в ОЦК-структуре кристаллизуются AgZn, Cu3Al, CoAl, Cu5Sn, LiAg, LiAl, TaH и др.
В объемно-центрированной кубической ячейке вольфрама атомы располагаются по вершинам и в центре ячейки, т.е. на одну ячейку приходится два атома. ОЦК-структура не является плотнейшей упаковкой атомов. Коэффициент компактности равен 0,68. Пространственная группа вольфрама Im3m.
Тип А3 (Структура магния)
В структурном типе магния кристаллизуются гексагональные металлы: кадмий, бериллий, таллий, титан, никель, хром и др. Эта структура также характерна для интерметаллических соединений AgCd, AgCd3, AuCd, AuCd3, CuCd3, AgZn3, AuZn3, NiMo, TiH, W2С и др.
Элементарная ячейка магния - элементарная примитивная. Центры атомов располагаются по вершинам правильных шестиугольников: в трех вершинах - через одну, - атомы верхнего слоя, в трех других вершинах - атомы нижнего слоя. Элементарная ячейка построена на трех трансляциях, две из которых лежат в плотно упакованном слое атомов и составляют между собой угол = 120о, третья перпендикулярна этому слою. Элементарную ячейку можно разделить плоскостью на две тригональные призмы. В центре одной из призм расположен атом, другая свободна, заселенные и пустые призмы чередуются между собой. На элементарную ячейку приходится два атома магния.
Каждый атом магния окружен двенадцатью ближайшими атомами: шестью - в том же слое, тремя в соседнем слое сверху и тремя в соседнем слое снизу, к.ч.=12. Плотные слои - плоскости базиса (0001), упаковка гексагональная, двухслойная....АВАВАВАВ.... Кристаллы металлов с плотно упакованной гексагональной структурой легче всего деформируются по плоскостям (0001) и направлениям, соответствующим наиболее плотной упаковке атомов. Координационный многогранник - гексагональный кубооктаэдр. Пространственная группа магния Р63/mmc.
Кристаллическая решетка - пространственная структура, которую формируют частицы, образующие кристаллы. Основу кристаллической решетки составляет элементарная решетка определенной геометрической формы, в вершинах (узлах) которой расположены атомы, молекулы или ионы.
Дефект кристаллической решетки - отклонение кристаллической решетки от ее идеального периодического строения.
Дефекты оказывают существенное влияние на физические свойства кристаллов.
Различают точечные дефекты (вакансии); линейные дефекты (дислокации); и
объемные дефекты: трещины, поры, раковины и т.д.
Дислокация - в кристаллах - линейный дефект кристаллической решетки, представляющий собой нарушение правильного чередования атомных плоскостей.
Вакансия - в кристаллах - отсутствие атома или иона в узле кристаллической решетки. Вакансии находятся в термодинамическом равновесии с кристаллической решеткой, они возникают и исчезают в результате теплового движения атомов.
Помимо этого есть ещё специфические дефекты полупроводников.
Акцептор - дефект кристаллической решетки полупроводника, в виде примесного атома, который может захватывать электроны из валентной зоны у доноров, образуя при этом дырки, участвующие в электропроводности.
Донор - дефект кристаллической решетки полупроводника, способный отдавать электроны в зону проводимости.
Доноры в полупроводниковом кристалле могут быть обусловлены примесью или дислокациями.
С физической точки зрения дефекты это нарушения порядка атомов или ионов в структуре. Различают дефекты по Шотки (незанятые узлы решетки) и дефекты по Френкелю (смещение местоположения ионов).
Две вакансии противоположного знака образуют дефект по Шотки.
Пара, состоящая из межузельного иона и оставленной им вакансии, называется дефектом по Френкелю.
Дефект кристаллической решетки - отклонение кристаллической решетки от ее идеального периодического строения.
Различают: точечные дефекты, линейные дефекты и объемные дефекты: трещины, поры, раковины и т.д
3. Большая часть получаемых в промышленных масштабах металлов используется для производства сплавов. Сплавы являются важным конструкционным материалом в промышленности, строительстве, машино- и авиастроении. Основная масса выплавляемых железа, титана, магния, алюминия используется на эти цели. Широкое применение во многих отраслях народного хозяйства металлы нашли во многом именно благодаря их способности образовывать сплавы при смешивании расплавленных металлов и последующем их затвердевании.
Очень ценным качеством сплавов является наличие у них свойств, которых нет ни у одного из компонентов сплава. Так, например, сплав золота с медью обладает значительной твердостью, хотя золото и медь представляют собой очень мягкие металлы.
Самое известное применение висмута — легкоплавкие сплавы на его основе. Чаще других используется сплав Вуда, массовая доля висмута в котором составляет 50 %, свинца — 25 %, олова — 12,5 % и кадмия — 12,5 %. Плавится этот сплав при 69 °С, хотя каждый из исходных металлов имеет значительно более высокую температуру плавления (Bi 271 °С, РЬ — 327 °С, Sn — 232 °С, Cd — 321 °С). Подобные сплавы применяют в качестве легкоплавких припоев, для изготовления предохранителей электрической аппаратуры.
Приведем состав некоторых из широко распространенных сплавов.
Чугун — сплав железа с углеродом (массовая доля более 2 %), содержащий небольшие количества кремния, марганца, фосфора, серы и др. По сравнению с чистым железом он обладает повышенной твердостью и высокой хрупкостью.
Сталь — сплав железа, в котором массовая доля углерода не превышает 2 %, содержащий также небольшие количества марганца, кремния, серы, фосфора и других примесей. Добавление в сталь вольфрама, ванадия, хрома, никеля и других металлов придает ей ряд очень ценных свойств (жаростойкость, устойчивость к коррозии, высокую твердость и др.).
Бронза — сплав меди с некоторыми другими металлами (оловом, алюминием, свинцом, кремнием и др.).
Латунь — сплав меди с цинком (массовая доля до 35 %). Обладает высокой пластичностью.
Нихром — сплав никеля, хрома, железа, марганца. Обладает высоким электрическим сопротивлением и высокой жаропрочностью.
Дуралюмин — сплав алюминия с небольшим количеством магния и меди.
Чёрные металлы — железо и его сплавы (стали, ферросплавы, чугуны), в отличие от остальных металлов, называемых цветными. К чёрным металлам также относят хром, марганец и ванадий, используемые главным образом при производстве чугунов и сталей[ источник не указан 119 дней ]. Чёрные металлы составляют более 90 % всего объёма, используемых в экономике металлов, из них основную часть составляют различные стали.
Кроме углерода в чугунах и сталях содержатся другие компоненты, такие как кремний, марганец, сера, фосфор.
Для получения чугунов и сталей с требуемыми свойствами (устойчивость к коррозии, упругость, ковкость и др.) к ним добавляют легирующие вещества: алюминий, марганец, молибден, медь, никель, хром.
Железо и его «производные»— сталь и чугун (см. Железо, сталь, чугун)—называют черными металлами. Все остальные металлы относятся к категории цветных. Золото, серебро, платина и другие благородные металлы тоже цветные. Все цветные металлы играют важную роль в промышленности.
Алюминий — самый распространенный на Земле металл — называют летающим металлом. Из него, вернее из его сплавов, самый известный из которых дуралюмин (сплав алюминия с медью, магнием и марганцем), делают фюзеляжи и крылья самолетов. Из сплавов алюминия была изготовлена оболочка нашего первого в мире искусственного спутника Земли.
Алюминий широко применяют в различных отраслях промышленности и в строительстве. Многие детали самых разных машин, перекрытия, наружная облицовка и оконные рамы высотных зданий, аппаратура для производства кислот и многих органических веществ, резервуары для хранения жидкого кислорода, моторные и весельные лодки, посуда, мебель — все это делается из алюминия.
Во Франции построен целиком алюминиевый океанский лайнер длиной свыше 300 м. Не только его корпус, но и внутренние переборки, стены кают, даже мебель — алюминиевые.
Медь имеет самую высокую (после серебра) электрическую проводимость. Из нее делают обмотки трансформаторов и генераторов, линии электропередачи (ЛЭП), электрические провода внутри машин и зданий и многие другие электротехнические изделия, а также коррозионностойкую химическую аппаратуру. Широко используют в технике и медные сплавы — латунь, бронзу и др.
Металл серебристо-белого цвета — магний химически очень активен. Если магний сильно нагреть, он ослепительно вспыхивает, давая яркое белое пламя. Раньше такой вспышкой магния пользовались при фотографировании.
Однако сплавы магния не только не загораются с повышением температуры, но остаются твердыми даже при таком нагреве, когда сталь плавится и течет. Поэтому из сплавов магния делают детали самолетов и двигателей, которые работают при очень высокой температуре. Применяются магниевые сплавы и в космических ракетах.
Еще большую роль играет в технике т и-т а н. Он почти вдвое тяжелее алюминия, зато в 6 раз прочнее его. Поэтому титановые детали можно делать очень тонкими, и они будут легче и прочнее алюминиевых. Кроме того, титан — чрезвычайно тугоплавкий металл. Его температура плавления 1668° С — выше, чем у стали. Поэтому самолеты из титановых сплавов достигли скоростей, в 2 и 3 раза превышающих скорость звука: их обшивка не плавится при больших температурах, образующихся при трении об атмосферу. Уникальна химическая стойкость титана. Химическое оборудование из титановых сплавов служит во много раз дольше, чем из нержавеющей стали.
Все большее применение в промышленности находит ртуть. Все знают ртутные термометры. Но ртуть входит и в состав некоторых лекарств, употребляется в горном деле («гремучая ртуть» в детонаторах), в электротехнике, в химической промышленности.
Разнообразие свойств цветных металлов обусловило и разные методы их получения.
Как и черные металлы, цветные получают из рудного концентрата: предварительно обогащенной руды (см. Обогащение полезных ископаемых). Но здесь процесс обогащения сложнее, поскольку в рудах всегда присутствуют и «посторонние» элементы, от которых необходимо избавляться. В первую очередь это сера, железо и кислород.
Сначала из руды путем «обмена» удаляют серу: место серы временно должен занять другой элемент. Обычно «заменителем» оказывается кислород. Делают это при обжиге руды: при высокой температуре металлы «соглашаются» расстаться с серой и принять на ее место кислород. Теперь перед металлургами новое соединение — оксид: соединение металла с кислородом. Иногда серу вытесняют не кислородом, а хлором. Тогда концентрат не обжигают, а хлорируют. Затем необходимо освободить металл от кислорода или хлора. С этим процессом — восстановлением металла — вы можете познакомиться в статье Доменная печь. При высоких температурах в расплав вводят углерод, водород или кремний. Кислород покидает металл и соединяется с этими элементами. Также и для хлора подбирают элементы, которые он «любит»: например, титан или цирконий освобождают от хлора с помощью магния.
Сложность получения цветных металлов хорошо видна на примере меди. Ее плавят в печах, напоминающих мартеновские (см. Мартеновская печь). Но выходит из печей не чистая медь, а так называемый штейн — сплав меди с железом, серой, серебром, золотом, цинком и другими элементами. Этих примесей в штейне 70—80%. Затем штейн заливают в конвертор и продувают через него воздух, в результате чего выжигаются остатки серы и удаляется железо. Занимает этот процесс часы, а не минуты, как в конверторе для переработки чугуна. Штейн превращается в черновую медь, которая содержит всего 1—2% примесей. Но и это слишком много.
Следующая стадия — очистка меди от примесей — огневое рафинирование. Выжигаются последние остатки серы и некоторых других элементов. Зато часть меди вновь окисляется. Чтобы освободить медь от кислорода, в ванну с расплавом погружают деревянные жерди, словно «дразнят» медь. Расплав при этом бурлит и фыркает. Эта операция так и называется — дразнение. Потом в печь забрасывают древесный уголь, который окончательно отбирает от меди кислород. Теперь примесей уже только десятые доли процента, и среди них золото и серебро.
С этим можно было бы мириться. Но электротехнике нужна очень чистая медь. Поэтому в дело вступает электролиз (см. Электрохимические методы обработки). Пластину очищаемой меди — анод — помещают в электролитическую ванну с раствором серной кислоты и медного купороса. Катодом служит лист чистой меди. Электрический ток переносит на катод только медь. Золото, платина и серебро опускаются на дно ванны, а другие примеси остаются в растворе. С помощью электролиза получают и многие другие цветные металлы. В первую очередь алюминий.
Получать алюминий тоже очень сложно. Его рудный концентрат — глинозем (оксид алюминия) плавится при 2050° С (это почти в 2 раза выше температуры плавления меди), да еще не отдает кислород углероду. Поэтому, чтобы снизить температуру плавки, приходится растворять глинозем в расплавленном криолите — минерале, в состав которого входят алюминий, натрий и фтор. Точка плавления этого раствора ниже 1000° С, а с такой температурой уже можно работать.
В электролитической ванне молекулы глинозема распадаются на составные части — ионы алюминия и кислорода. Электрический ток разносит их в разные стороны. Алюминий осаждается на катод, которым является угольное дно самой ванны. Отсюда его потом и собирают.
Так же с помощью электролиза получают титан, магний, кальций, бериллий и другие металлы, разлагая их соединения с хлором. Хлористые соли этих металлов нагревают до 500—700° С и заливают в ванну с электролитом.
Однако цветные металлы можно получать и без нагрева — с помощью жидкости. Есть целая отрасль — гидрометаллургия (см. Металлургия). Металл переводят в раствор с помощью химического растворителя — воды или растворов кислот, щелочей и солей.
Из раствора чистый металл извлекают разными способами. В одних случаях с помощью электролиза (см. Электрический ток), в других прибегают к обменным химическим реакциям, но тоже в электролизной ванне. Суть их в том, что анодом служит какой-либо другой металл, который отдает в раствор свои ионы. А из раствора извлекают ионы нужного металла. Так получают, например, цинк.
В рудных концентратах цветных металлов присутствует ряд элементов. Поэтому у нас есть комбинаты, получающие из концентрата (его называют комплексным или полиметаллическим) около 20 химических элементов. Их последовательно извлекают из раствора каждый раз особым реактивом. Для 'этого применяют и о н и т ы — особые синтетические смолы. Они обладают избирательной способностью: погруженные в соответствующий раствор, Забирают из него только один элемент, скажем ионы золота. Иониты значительно ускоряют и удешевляют получение металлов. С их помощью выгодно даже извлекать драгоценные металлы из морской воды.
В последнее время все большее распространение получило бактериальное выщелачивание. Некоторые виды бактерий растворяют в воде определенные металлы или их соединения, а также вредные примеси (например, мышьяк).
Так называемые тионовые бактерии растворяют медь, уран, цинк, кобальт, марганец и др. Для растворения и извлечения золота применяют гетеротрофные бактерии, выделенные из рудниковых вод золотоносных приисков.
Аппаратура для бактериального выщелачивания очень проста. Это дает возможность резко снизить себестоимость полезных ископаемых и значительно увеличить их добычу за счет использования бедных руд и отвалов из отходов обогащения руды, шлаков и др.
4. Сталь – деформируемый (ковкий) сплав железа с углеродом (до 2%) и другими элементами. Сталь – важнейший материал, применяемый в большенстве отраслей промышленности. К стали, в зависимости от применения, предъявляют разнообразные требования. Существует большое число марок сталей, различающихся по химическому составу, структуре, физическим и механическим свойствам.
Основные характеристики стали (плотность стали, модуль упругости и модуль сдвига стали, коэффициент линейного расширения и т.д.) приведены на странице" физические свойства стали".
По химическому составу стали делятся на углеродистые и легированные. Углеродистая сталь наряду с железом и углеродом содержит марганец (0,1-1,0%), кремний (до 0,4%).
Сталь содержит также вредные примеси (фосфор, серу, газы - несвязанный азот и кислород). Фосфор придает стали хрупкость (хладноломкость) при низких температурах, уменьшает пластичность при нагревании. Сера вызывает трещиноватость при высоких температурах (красноломкость).
Для изготовления сварных конструкций в основном применяется углеродистая сталь обыкновенного качества, соответствующая ГОСТ 380-71. Для придания стали каких-либо особых свойств – механических, электрических, магнитных, коррозионной устойчивости и т.д. – в нее вводят так называемые легирующие элементы, как правило, металлы: хром, никель, молибден, алюминий и др. Такие стали называют легированными.
Свойства стали можно изменять, применяя различные виды обработки: термическую (закалка, отжиг), химико-термическую (цементизация, азотирование), термо-механическую (прокатка, ковка). При обработке стали для получения необходимой структуры используют свойство полиморфизма, присущее стали так же, как и их основа – железу. Полиморфизм – способность кристаллической решетки менять свое строение при нагреве и охлаждении. Взаимодействие углерода с двумя модификациями (видоизменениями) железа - α и γ – приводит к образованию твердых растворов. Избыточный углерод, не растворяющийся в α-железе, образует с ним химическое соединение - цементит Fe3C. При закалке стали образуется метастабильная фаза - мартенсит – пересыщенный твердый раствор углерода в α-железе. Сталь при этом теряет пластичность и приобретает высокую твердость. Сочетая закалку с последующим нагревом (отпуском), можно добиться оптимального сочетания твердости и пластичности.
По назначению стали делятся на конструкционные, инструментальные и стали с особыми свойствами. Конструкционные стали применяют для изготовления строительных конструкций, деталей машин и механизмов, судовых и вагонных корпусов, паровых котлов. Инструментальные стали служат для изготовления резцов, штампов и других режущих, ударно-штамповых и измерительных инструментов. К сталям с особыми свойствами относятся электротехнические, нержавеющие, кислотостойкие и др.
По способу изготовления сталь бывает мартеновской и кислородно-конверторной (кипящей, спокойной и полуспокойной). Кипящую сталь сразу разливают из ковша в изложницы, она содержит значительное количество растворенных газов. Спокойная сталь - это сталь, выдержанная некоторое время в ковшах вместе с раскислителями (кремний, марганец, алюминий), которые соединяясь с растворенным кислородом, превращаются в оксиды и выплывают на поверхность массы стали. Такая сталь имеет лучший состав и более однородную структуру, но дороже кипящей на 10-15%. Полуспокойная сталь занимает промежуточное положение между спокойной и кипящей.
В современной металлургии сталь выплавляют в основном из чугуна и стального лома. Основные виды агрегатов для ее выплавки: мартеновская печь, кислородный конвертер, электропечи. Наиболее прогрессивным в наши дни считается кислородно-конвертерный способ производства стали. В то же время развиваются новые, перспективные способы ее получения: прямое восстановление стали из руды, электролиз, электрошлаковый переплав и т.д. При выплавке стали в сталеплавильную печь загружают чугун, добавляя к нему металлические отходы и железный лом, содержащий оксиды железа, которые служат источником кислорода. Выплавку ведут при возможно более высоких температурах, чтобы ускорить расплавление твердых исходных материалов. При этом железо, содержащееся в чугуне, частично окисляется:
2Fe + O2 = 2FeO + Q
Образующийся оксид железа (II) FeO, перемешиваясь с расплавом, окисляет, кремний, марганец, фосфор и углерод, входящие в состав чугуна:
Si +2FeO = SiO2 + 2 Fe + Q
Mn + FeO = MnO + Fe + Q
2P + 5FeO = P2O5 + 5Fe + Q
C + FeO = CO + Fe – Q
Чтобы довести до конца окислительные реакции в расплаве, добавляют так называемые раскислители – ферромарганец, ферросилиций, алюминий.
Использование стали в жизни человека разнообразно и многогранно, порой мы даже не замечаем, что без металла не обходится большинство конструкций, механизмов, деталей и так далее. Сталь – это сплав железа и углерода, отсюда ее прочность и твердость, с которой может справиться только плазменная резка. Наличие хрома, никеля, вольфрама, молибдена позволяют изменять свойства металла, причем от массовой доли углерода или дополнительных металлов зависит и качество производимого продукта.
В родном панельном доме не обойтись без армированных конструкций: железобетон содержит арматурную сталь различного диаметра - проволока в мотках (диаметром до 10 мм) и в прутках длиной 6-12 м (более 10мм в диаметре). Современные технологии позволяют использовать арматурную сталь с минимальным количеством отходов – используется сварка и резка металла для наиболее точного подбора длины. Возможна сварка плоских сеток из более тонкой мотковой стали - так формируют пространственные арматурные конструкции; из этой же стали на месте строительства моделируют всевозможные скобы, хомуты, петли. Поскольку сталь подразделяется также по методу производства, то холоднотянутая – это арматурная проволока низкоуглеродистая B-I, углеродистая В-П, арматурная сталь А-Ш, высокопрочная A-IV, а горячекатаная – пруток класс A-I, A-1I, А-Ш, A-IV.
От фундамента до крыши в доме можно найти металл: металлочерепица – это оцинкованный стальной лист толщиной, от 0,37 до 0,75 мм, шириной 1,18 м, длиной 0,5 – 8 м с нанесением специальных покрытий и красок. Кстати по внешнему виду можно определить качество: чем круче волна, тем прочнее изделие. Можно для кровли использовать и листовую сталь, однако куда удобнее ее применение для автоматических ворот, где плазменная резка металла поможет нанести неповторимый рисунок, а может быть и фамильный герб. Металлические лестницы, козырьки, ступени, перила, оградки, навесы, всевозможные профили, балки и многое другое - это все сталь.
Ни один дом не будет собран без гвоздя, гайки, болта, ни одна машина не поедет без подшипников и рессор. Все это изделия из автоматной стали, используемой для производства деталей в строительстве, тракторной, автомобильной и машиностроительной промышленности при помощи штамповки и резания автоматным способом АС11, АС40 А12, А20 АЦ45Г2, АСЦ30ХМ, АС20ХГНМ. Кстати, рессорные пружины также изготавливают из специальных марок: сталь 65 - 85, 65Г, 70Г, 55С2, 60С2, 60С2Г, 50ХГ конструкционных рессорно-пружинных сталей (ГОСТ 14959-79), которые упрочняют закалкой, способных выдержать высокое сопротивление при малых деформациях. Для отпуска пружин необходимой длины используется плазменная резка металла. Эти стали дополнительно легируют хромом, марганцем, вольфрамом, никелем или кремнием, что и позволяет придать металлу вышеперечисленные свойства. Сталь марки ШХ15, ШХ15СГ со свойствами контактной выносливости, твердости и прочности используется в производстве шарикоподшипников. Охлаждение деталей перед отпуском обеспечивает повышенную стабильность и увеличивает срок годности изделия.
Однако и обработка стали происходит при помощи стали – из нее изготавливаются все высококачественные колюще-режущие предметы и производится резка металла. Существуют специальные марки стали повышенной твердости: углеродистые, низкоуглеродистые, легированные и быстрорежущие. Углеродистые стали (ГОСТ 1435-74) имеют малый температурный диапазон, страдают от перегрева - используются в малоответственном инструментарии: сталь марки У7, У7А в производстве зубил, ножниц по металлу, плоскогубцев, клещей и прочего инструментария. Легированные стали (ГОСТ 5950-2000) имеют средний температурный диапазон, при нагревании не теряют своих свойств, обладают достаточной износостойкостью; так из сталей марок ХВГ, 9ХВГ производят режущий и измерительный инструмент, матрицы и лекала для многоразовой штамповки, специализированный точный инструментарий. Быстрорежущие стали (ГОСТ 19265-73) относятся к самым прочным, износостойким, твердым, с большим температурным диапазоном, не подвержены деформации Р6М5, Р6М5К5, Р18, Р18Ф2. Используются для точных режущих инструментов (фрез, ножей, сверл, метчиков) в том числе и в сталепрокатном цеху.
Современные технологии почти полностью зависят от электропитания, где в производстве дросселей, трансформаторов и генераторов применяют электротехническую сталь (ГОСТ 11036-75) марок 20832, 11832, 21832, 10848, 20848, обладающих магнитными свойствами содержащую различную массовую часть кремния. Специальные технологии обработки позволяют получить заданный уровень магнитных свойств в каждом конкретном случае, причем плазменная резка никоим образом не изменяет свойства металла. Характеристики этих сталей: изотропность - разница магнитных свойств в продольном и поперечном направлении, магнитная индукция – чем она выше, там меньше размер магнитопровода.
Однако машиностроение это не только режущий материал, а и непосредственно станки, краны, вагоны, производственные металлоконструкции, конечно же, состоящие из металла – конструкционной стали, обладающей высокой прочностью к давлению, плавлению, растрескиванию и погодным условиям. В частности высоколегированные стали 14ХН4А, 38Х2Н5М, 20ХН3А используют для наиболее тяжелонагружаемых деталей машин (не стоит забывать, что легирование – закалка позволяет увеличить прочность стали). Для теплоустановок, паровых котлов применяют теплоустойчивые марки 12К, 15К, 18К, 20К. В противовес этому для холодильных установок применяют криогенные марки сталей ОН6А, ОН9А, невосприимчивые к низким температурам с пониженной хрупкостью и ломкостью, в основном этот низкоуглеродные никелевые стали с высокой коррозионнойстойкостью. Также в емкостях из сталей данных марок хранят и сжиженные газы, находящиеся в температурном пределе до 180-195°С. Эти виды сталей относятся к высокоспециализированным, однако плазменная резка позволяет избежать растрескивания и разрушения металла.
Изделия из стали необходимы и в быту: разнообразие кухонной утвари – ножей, ножниц, овощечисток, терок поражает. Кроме режущих инструментов все большую популярность приобретает посуда (кастрюли, чайники, кружки) из нержавеющей стали. В данном случае применяется коррозионностойкая легированная сталь, с содержанием хрома 17-20%, например марки 12Х18Н9. Принадлежит к высококачественным холоднокатаным сталям (ГОСТ 27002-86), технологии позволяют сделать матовые и глянцевые поверхности, одно и двухслойные емкости. Резка металла далеко не домашнее занятие, что совсем не относится к заточке – новое чудо технологий – самозатачивающиеся ножи – это опять-таки пример использования стали. Продолжать можно очень долго, так как область применения данного металла безгранична.
Чугун
Чугун - это железоуглеродистый сплав, содержащий более 2,14% углерода. Однако указанная граница (2,14% C) относится только к двойным железоуглеродистым сплавам или сплавам, содержащим сравнительно небольшое число примесей. Вопрос о границе между сталями и чугунами в высоколегированных железоуглеродистых сплавах, т.е. содержащих ещё большее количество других элементов, кроме железа и углерода, является спорным. Железоуглеродистые сплавы затвердевают с образованием эвтектики.
Чугун - важнейший первичный продукт черной металлургии. Чугун вторичной плавки - один из основных конструкционных материалов, используемый как литейный сплав.
Чугун отличается от стали по составу - более высоким содержанием углерода, по технологическим свойствам - лучшими литейными качествами, малой способностью к пластической деформации (в обычных условиях не поддаётся ковке). Чугун дешевле стали.
Дата добавления: 2015-07-11; просмотров: 307 | Нарушение авторских прав