
|
Читайте также: |
1. Основы теории электролитической диссоциации
2. Характер взаимодействия чистого Ме с раствором электролита
3. Кинетика электродных процессов
4. Пассивность Ме
1. Электрохимическая коррозия – коррозия Ме, сопровождающаяся появлением электрического тока. Развивается в растворах электролитов.
Электролит – жидкий раствор вещества, который диссоцицирует на ионы, что и обеспечивает электропроводность раствора. Электролиты: водные растворы неорганических кислот, солей и оснований.
Диссоциацию в электролитах вызывают жидкости-растворители с полярным строением молекул (Н2О):  .
.

Взаимодействие диполей воды с ионами называется гидротацией. В целом раствор остается электронейтральным.
2. При погружении чистого Ме в раствор электролита происходит гидратация его поверхностных ион-атомов.

А) F1>F2, поверхностные ион-атомы переходят в раствор, металл разрушается и приобретает некоторый отрицательный заряд из-за избытка свободных электронов. Этот заряд будет удерживать перешедшие в раствор катионы вблизи его поверхности. При этом электроны в металле за счет электростатического взаимодействия с катионами раствора также сосредотачиваются около поверхности Ме. Нейтрализовать друг друга эти заряды не могут, т.к. между ними находятся молекулы воды, тем самым образуя заряженный конденсатор.

Характеризуется определенным скачкообразным изменением потенциала. Электрическое поле противодействует силе гидратации( ), и при определенной величине скачка потенциала растворение Ме прекращается. Достигается динамическое равновесие, устанавливается определенное значение отрицательного потенциала Ме относительно электролита, зависящее от свойств Ме и свойств электролита.
), и при определенной величине скачка потенциала растворение Ме прекращается. Достигается динамическое равновесие, устанавливается определенное значение отрицательного потенциала Ме относительно электролита, зависящее от свойств Ме и свойств электролита.
Переход ион-атомов Ме в раствор в виде гидратированных Катионов – есть первичный процесс коррозии, который называется анодный.
Интенсивность анодного процесса - Ia, направленный из металла в среду.
Ia – местная плотность анодного тока, ia прямо пропорционально  .
.
Возможен и противоположный процесс:
Б) F1<F2, тогда заполнение внешних связей поверхностных ион-атомов Ме произойдет за счет адсорбции на поверхность Катионов электролита (преодоление сил гидратации). Они сообщают избыточный положительный заряд присоединяя к себе свободные электроны отбирая их у Ме. Двойной слой образуется и в этом случае, но электрическое поле направлено так, что дальнейшее осаждение положительных ионов электролита прекращается при некоторой разности потенциалов. Ме приобретает относительно электролита вполне определенный положительный потенциал. Этот процесс называется катодным.

Интенсивность общую и местную измеряют Iк и плотностью тока iк, прямо пропорционально скорости расходования компонента среды.
И отрицательный, и положительный потенциал относительно электролита экспериментально измерить нельзя, т.к. к раствору нельзя подвести контакт из измерительного устройства не дающей с этим раствором собственный и тоже неизвестную разность потенциалов.
Однако, если в электролит поместить кроме изучаемого Ме какой-нибудь электрод сравнения, потенциал которого относительно электролита принять условно за 0, то легко определить разность потенциалов между изучаемым и 0-ым электродом. Материал, имеющий условно 0 потенциал относительно электролита, принят водород. Он состоит из губчатой платины, насыщенной водородом и помещенный в раствор кислоты, содержащий 1г катиона водорода на 1 литр раствора, такой электрод называется нормальным водородным электродом (Н.В.Э.).
Если потенциал металла определен относительно другого удобного электрода сравнения (например, М.С.Э. – медн-сульфадный, Сu в растворе CuSO4), то:
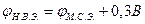
Таким образом основные процессы электрохимической коррозии сильно зависят от электродного потенциала Ме.
Существуют электрохимические, гальванические ряды напряжений в конкретной среде.
 в 3% растворе NaCl
в 3% растворе NaCl
| Ме |  , В , В
|
| Ag (серебро) | + 0,2 |
| Cr | + 0,23 |
| Cu | + 0,02 |
| Ni | -0,02 |
| Sn (олово) | -0,25 |
| Fe | -0,50 |
| Al | -0,63 |
| Zn | -0,83 |
3. Кинетика электродных процессов.
Если 2, находящихся в контакте, Ме при воздействии на них электролита приобретут различные потенциалы ( ), то образуется гальванический элемент или гальванопара. Пластины Ме, имеющие более отрицательный потенциал, будут выступать в качестве анода и непрерывно будут отдавать в раствор свои катионы (корродируют). Вторая пластина, имеющая более положительный потенциал, становится катодом и служит местом разрядки катионов раствора, т.е не подвергается коррозионному разрушению. Интенсивность коррозионного разрушения анода будет тем больше, чем больше разность электродных потенциалов анода и катода. Процесс разрушения в гальванопаре с течением времени обычно замедляется и даже прекращается из-за поляризации электродов.
), то образуется гальванический элемент или гальванопара. Пластины Ме, имеющие более отрицательный потенциал, будут выступать в качестве анода и непрерывно будут отдавать в раствор свои катионы (корродируют). Вторая пластина, имеющая более положительный потенциал, становится катодом и служит местом разрядки катионов раствора, т.е не подвергается коррозионному разрушению. Интенсивность коррозионного разрушения анода будет тем больше, чем больше разность электродных потенциалов анода и катода. Процесс разрушения в гальванопаре с течением времени обычно замедляется и даже прекращается из-за поляризации электродов.
Поляризация – изменение потенциалов электродов в процессе коррозии (уменьшение разности потенциалов). Различают анодную и катодную поляризации.
Анодная поляризация – повышение потенциала анода путем сосредоточения вблизи его поверхности катионов корродирующего Ме. Этому способствюет:
А) Вязкость раствора
Б) Накопление на аноде продуктов коррозии
Катодная поляризация – снижение  катода за счет накопления на нем перешедших с анода электронов.
катода за счет накопления на нем перешедших с анода электронов.
Замедление коррозии, обусловленной поляризацией, может быть 2-3 раза. Однако параллельно с поляризацией происходит обратный процесс – деполяризация – увеличение разности потенциалов.
Пример:

1) Если пластины этих металлов изолированы друг от друга, то каждый Ме приобретет потенциал в соответствии с таблицей, Е= -0,83 – (-0,5)= -0,33 В.
2) Соединим эти 2 гвоздика
 - кислородная деполяризация
- кислородная деполяризация

Водородная деполяризация:

4. Пассивность Ме – состояние Ме, когда она обнаруживает повышенную коррозионную стойкость. Сопровождается резким изменением  в положительную область (наоборот – активность).
в положительную область (наоборот – активность).
Резкое уменьшение скорости коррозии вследствие перехода Ме из активного в пассивное состояние называется пассивацией.
Пассивируются: Cr, Ti, Al, нержавейка
Среды пассивации: хромовая кислота,  (бихромат калия), газообразные окислители,
(бихромат калия), газообразные окислители, 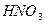
Самопассивирующиеся – пассивирующиеся в атмосфере.

Теория образования пассивной пленки (Кистеновского), (толщина пленки от 3 до 50 ангстрем):
1) Стойкость пленки против коррозии в данной среде;
2) Предотвращение пленкой взаимодействия среды и Ме;
3) Сплошность и плотность пленки.
V1 – объем пленки, V2 – объем прокородировавшегося Ме.

Дата добавления: 2015-07-11; просмотров: 56 | Нарушение авторских прав